Synteza i chemiluminescencja lofiny - zimne światło, muzyka i migdały
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (5/2020):

Wiele substancji posiada zdolność do chemiluminescencji, jednak ich praktyczne wykorzystanie jest często problematyczne. Lucyferyna z lucyferazą są drogie i trudnodostępne, proces produkcji singletowej odmiany tlenu może być niebezpieczny z racji używania w nim silnie trujących i żrących substancji, biały fosfor sam w sobie jest wręcz odstręczająco toksyczny. Interesujący układ pirogalol-formaldehyd jest stosunkowo tanim i bezpiecznym przykładem chemiluminescencji, ale efekt nie zawsze jest zadowalający. Pochodne szczawianów także są stosunkowo drogie i rzadko dostępne, a ich samodzielna produkcja w domowych warunkach może nastręczać trudności mniej zaawansowanym chemikom. Synteza luminolu jest możliwa w lepiej wyposażonym laboratorium szkolnym lub uczelnianym, ale niewątpliwie wymaga nieco zachodu. Dlatego w tym artykule zajmę się lofiną C21H16N2, którą w niezbyt skomplikowany sposób można zsyntezować w domowych warunkach, wykorzystując tanie i łatwo dostępne substancje.
Dodatkowo ma to tę zaletę, że własnoręczne otrzymanie substancji dostarcza oczywiście wielkiej satysfakcji, szczególnie jeśli umożliwia ona tak efektowne doświadczenia.

Zaskakujące związki
Powyższy nagłówek nie jest jedynie pustymi słowami - rzeczywiście chodzi tu o interesujące powiązania między - zdawałoby się - zupełnie odrębnymi sprawami. Co wspólnego może mieć rosyjski kompozytor muzyki klasycznej, polski chemik, smakowite migdały oraz poszukiwana przez nas lofina? Postaram się to wyjaśnić w dalszej części artykułu.
Aleksander Borodin był żyjącym w XIX wieku znakomitym rosyjskim chemikiem. Odniósł wiele wspaniałych osiągnięć na polu chemii organicznej. Rosjanin miał jednak także inną pasję, którą zajmował się obok pracy naukowej - był kompozytorem. Wraz z Bałakirewem, Cui, Musorgskim i Rimskim-Korsakowem tworzył Potężną Gromadkę - grupę sławnych kompozytorów nawiązujących do tradycyjnej rosyjskiej muzyki ludowej. Komponował symfonie, poematy symfoniczne, fantazje i kwartety smyczkowe. Największe uznanie zdobyła opera "Kniaź Igor", z piękną partią "tańców połowieckich".
Co ciekawe, Borodin zawsze ubolewał, że był bardziej znany jako kompozytor (co uważał jedynie za uboczne, mniej ważne zajęcie) niż naukowiec. My oddajmy mu jednak honor, doceniając go także jako chemika.
Borodin jako pierwszy otrzymał hydrobenzamid (tribenzylidenodiiminę C21H18N2), o interesującym wzorze strukturalnym (Rys.1).
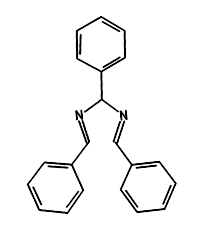
Hydrobenzamid został wytworzony w wyniku kondensacji aldehydu benzoesowego C6H5CHO i amoniaku NH3. Aldehyd benzoesowy jest z kolei substancją, która nadaje migdałom ich charakterystyczny zapach.
Tutaj na scenę wkracza kolejny chemik, tym razem nasz rodak. Mowa tu o Bronisławie Radziszewskim. Jest on autorem kilkuset prac naukowych z zakresu chemii; opracował wiele metod otrzymywania związków pierścieniowych. Zajmował się także związkami heterocyklicznymi, czyli takimi, które w pierścieniu zawierają obok węgla także atomy innych pierwiastków. Radziszewski opisał metody syntezy imidazoli, między innymi właśnie lofiny C21H16N2, która formalnie jest 2, 4, 5- trifenylimidazolem (Rys.2).
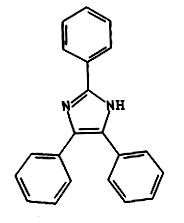
Skoro zaczerpnęliśmy nieco wiedzy na interesujący nas temat, to możemy z czystym sumieniem pójść śladem obu uczonych. Synteza lofiny, a następnie pokaz jej świecenia z pewnością zapewnią ciekawe przeżycia - nie tylko natury poznawczej, ale także estetycznej.
Otrzymywanie
Synteza jest dwuetapowa: najpierw wytworzymy pewną ilość hydrobenzamidu, który następnie przeprowadzimy w lofinę.
W pierwszym etapie będziemy potrzebować tylko dwóch odczynników:
- aldehyd benzoesowy,
- woda amoniakalna (wodny roztwór amoniaku) 25%.
Warto wziąć pod uwagę, że podczas syntezy i doświadczeń występują pewne niebezpieczeństwa. Woda amoniakalna jest żrąca, a ulatniający się z niej amoniak jest drażniący dla oczu, skóry i dróg oddechowych. Amoniak w większych stężeniach jest silnie trujący. Pary aldehydu benzoesowego są szkodliwe przy wysokiej koncentracji. Alkohol etylowy jest łatwopalny. Lofina w większych ilościach jest trująca, może wykazywać także działanie drażniące. Trzeba stosować środki ochrony osobistej! W czasie produkcji lofiny może dochodzić do uwalniania toksycznych i drażniących par - reakcję należy prowadzić pod wyciągiem lub na świeżym powietrzu! Cyklizacja hydrobenzamidu wymaga wysokich temperatur (około 200°C), może też dochodzić do rozprysku wrzącej cieczy.
Aldehyd benzoesowy jest przejrzystą cieczą, o silnym zapachu migdałów. Należałoby jednak powiedzieć odwrotnie, ponieważ migdały zawdzięczają swój charakterystyczny zapach właśnie tej substancji! Stąd można wysnuć wniosek, że do doświadczenia można użyć aldehydu benzoesowego otrzymanego z nasion śliwy migdał Prunus dulcis, nazywanej też migdałowcem. Ja jednak wykorzystałem czysty aldehyd, otrzymany syntetycznie.
Aldehyd benzoesowy łatwo się utlenia, dlatego należy go chronić przed dostępem powietrza. Wraz z postępem tego procesu ciecz staje się najpierw żółtawa, a potem brunatna. Do naszego doświadczenia jest potrzebny świeży aldehyd, bezbarwny, lub co najwyżej z delikatnym żółtym zabarwieniem.
Przygotowanie reakcji jest proste. Do kolby wlewamy około 12cm3 aldehydu benzoesowego oraz około 40cm3 wody amoniakalnej o stężeniu 25%. Zawartość mieszamy i odstawiamy na okres 24 do 48 godzin. W tym czasie dochodzi do reakcji przedstawionej na Rys.3.
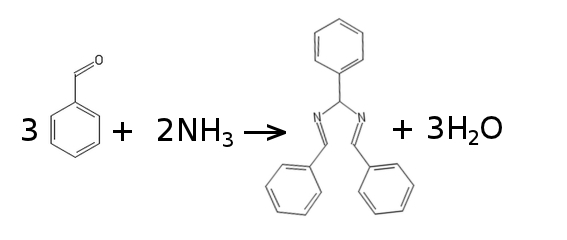
Po upływie wskazanego czasu zauważamy, że doszło do wytrącenia białego lub kremowego osadu. Jest to właśnie potrzebny nam hydrobenzamid. Osad należy odsączyć, a potem kilkukrotnie przemyć wodą. Ostatnie przemywanie należy wykonać przy użyciu niewielkiej ilości alkoholu etylowego. Hydrobenzamid trzeba dokładnie wysuszyć, ale musi się to odbywać w niezbyt wysokiej temperaturze (maksymalnie 50°C). W innym wypadku mogłoby dojść do hydrolizy związku. Gotowy, suchy hydrobenzamid ma postać białej substancji krystalicznej (Fot.1).
Po otrzymaniu hydrobenzamidu jesteśmy więc już na półmetku drogi do uzyskania lofiny.
Bronisław Radziszewski opracował dwie metody otrzymywania lofiny: pierwsza została zarzucona po odkryciu drugiej, o dużo większej wydajności. Mimo niewielkiej wydajności, zdecydowałem się przeprowadzić pierwszą, historyczną reakcję syntezy lofiny. Jej wielką zaletą jest brak konieczności użycia drogich odczynników i dużych ilości rozpuszczalników.
Historyczna metoda polega na cyklizacji hydrobenzamidu z użyciem tlenu atmosferycznego. Radziszewski po prostu mieszał ciekły, gorący hydrobenzamid przy dostępie powietrza.
Korzystając z przykładu uczonego wprowadźmy wytworzony, suchy hydrobenzamid do zlewki (Fot.2).
Substancję w naczyniu musimy następnie ogrzać na płycie grzejnej. Po pewnym czasie substancja stopi się; będzie wtedy miała postać słomkowożółtej cieczy (Fot.3).
Podgrzewając ciecz dalej, w pewnym momencie zauważymy zmianę jej barwy na ciemniejszą (Fot.4).
Zgodnie z metodą Radziszewskiego powinniśmy teraz energicznie mieszać ciecz bagietką. Wprowadziłem tutaj jednak pewną prostą, ale ważną innowację, która nieco zwiększa efektywność metody. Zamiast mieszać ciecz zastosowałem napowietrzanie. Do gorącego hydrobenzamidu wprowadziłem szklaną pipetę pasteurowską, przez którą dostarczałem sprężone powietrze.

Strumień powietrza dostarcza do roztworu większą ilość tlenu, a także efektywnie miesza ciecz. W czasie prowadzenia reakcji uwalnia się spora ilość drażniących par. Napowietrzanie należy prowadzić przez kilka minut, czas trzeba dobrać eksperymentalnie. Otrzymaną substancję pozostawiamy do ochłodzenia i zestalenia.
Z chemicznego punktu widzenia dochodzi tutaj do cyklizacji hydrobenzamidu (Rys.4).
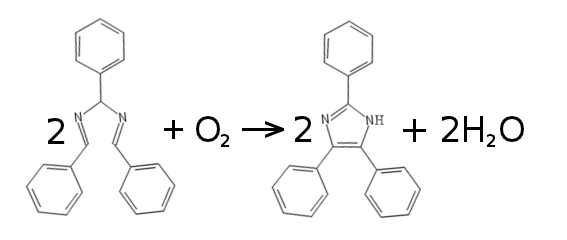
Pod wpływem tlenu z powietrza dochodzi wytworzenia pierścienia imidazolowego zawierającego dwa atomy azotu N. W ten właśnie prosty sposób otrzymaliśmy 2, 4, 5 - trifenylimidazol czyli lofinę.
Po ochłodzeniu otrzymujemy szklisty, brązowy stop (Fot.5).
Jest to surowa lofina, zawierająca dużą ilość zanieczyszczeń. Do doświadczeń z chemiluminescencją można użyć nawet zanieczyszczonej lofiny, ale można też ją w prosty sposób oczyścić.
Otrzymany stop należy rozpuścić w jak najmniejszej ilości gorącego etanolu C2H5OH lub izopropanolu C3H7OH . Po ochłodzeniu z roztworu krystalizuje lofina, którą należy przemyć alkoholem, tym razem już zimnym. Tak oczyszczona lofina prezentuje się już o wiele lepiej, jako drobne śnieżnobiałe kryształki (Fot.6).
Udało się; własnoręcznie otrzymaliśmy lofinę. Teraz możemy przystąpić do testowania jej zdolności do chemiluminescencji.
Finał!
By zmusić lofinę do świecenia potrzebujemy, oprócz niej, substancji z listy:
- wodorotlenek sodu NaOH,
- nadtlenek wodoru H2O2 30% (perhydrol) lub 3% (apteczna woda utleniona),
- chloran(I) sodu NaClO lub heksacyjanożelazian(III) potasu K3[Fe(CN)6],
- woda destylowana.
Reakcję można przeprowadzić w dwóch wariantach: może być ona wyzwalana przez chloran(I) sodu lub heksacyjanożelazian(III). Użycie soli kompleksowej jest wygodniejsze z racji możliwości jej wykorzystania w stałym stanie skupienia, jednak osiągany efekt jest nieco słabszy, niż przy wykorzystaniu chloranu(I). Na szczęście chloran(I) sodu jest łatwy do zdobycia i nie trzeba go wcale kupować w specjalistycznym sklepie chemicznym. Związek ten jest składnikiem wielu wybielaczy, szczególnie tych najtańszych. Są one często po prostu roztworami tej substancji, zwykle z dodatkiem wodorotlenku sodu . Do doświadczenia można użyć bezpośrednio takiego wybielacza, inne jego składniki nie powinny stanowić problemu. Poniżej przedstawię przepis reakcji z wykorzystaniem chloranu(I).
Musimy przygotować roztwory:
- A - 0,2g lofiny w 10cm3 etanolu,
- B - 3 cm3 nadtlenku wodoru 3% lub kilka kropli 30% uzupełnić etanolem do objętości 25cm3,
- C - 1g wodorotlenku sodu w niewielkiej ilości wody destylowanej, uzupełnić etanolem do objętości 20cm3,
- D - 5cm3 chloranu(I) sodu 4% (wybielacz) uzupełnić wodą do objętości 20cm3.
Roztwory są trwałe, można je dosyć długo przechowywać.
By przeprowadzić reakcję, najpierw należy zmieszać roztwory A, B i C. Następnie przy zgaszonym świetle wlewamy do mieszaniny wolnym strumieniem roztwór D.
Podczas dodawania ostatniego roztworu ciecz rozbłyskuje pięknym zielonkawo-żółtym światłem! Jest to doskonale widoczne także na zdjęciach o wydłużonym czasie ekspozycji (Fot.7).
Jasność powstającego światła, silnie zależy od temperatury. Po podgrzaniu reakcja zachodzi energiczniej, więc światło będzie jaśniejsze, ale świecenie będzie trwało krócej.
W przypadku użycia heksacyjanożelazianu(III) potasu postępujemy analogicznie. Jedyną różnicą jest to, że zamiast dolewania roztworu D wrzucamy do mieszaniny A+B+C kilka kryształków tej substancji i wstrząsamy zawartość naczynia.
Wyjaśnienie
Lofina jest jedną z pierwszych całkowicie syntetycznych substancji chemicznych wykazujących efekt chemiluminescencji. Nic więc dziwnego, że zjawisko jej świecenia zostało dosyć dokładnie zbadane i poznane. Dzięki temu mogę przedstawić proponowany mechanizm tego procesu.
Omawiana substancja jako 2,4,5-trifenylimidazol należy do grupy związków chemicznych nazywanych imidazolami. Emisja światła następuje podczas utleniania. Reakcja przebiega prawdopodobnie według uproszczonego schematu ukazanego na Rys.5.
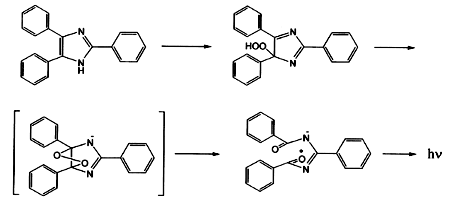
W środowisku alkalicznym, w obecności jonów podchlorynowych ClO- lub cyjanożelazianowych(III) [Fe(CN)6 ]3- lofina jest utleniana przez nadtlenek wodoru. Jeden z atomów azotu posiada luźno związany atom wodoru, o właściwościach kwasowych. Drugi atom azotu z kolei ma właściwości zasadowe, więc lofina jako całość jest związkiem amfoterycznym. Podczas utleniania dochodzi do powstania mostka nadtlenowego; utworzony cykliczny nadtlenek jest bardzo nietrwały. Występuje on w stanie wzbudzonym, o wyższej energii niż stan podstawowy. Szybko dochodzi do jego rozpadu; zgodnie z zasadą zachowania nadwyżka energii zostaje oddana do środowiska, tutaj pod postacią światła o długości fali λ=525nm. Światło takie ma barwę zielonkawo-żółtą.
Mechanizm prezentowanej reakcji jest podobny do procesów zachodzących podczas utleniania luminolu, kiedy także dochodzi do chemiluminescencji.
Chemiluminescencja lofiny nie jest jedynie ciekawostką; ma zastosowanie w analityce chemicznej do bardzo czułego wykrywania obecności wielu metali, między innymi kobaltu.
Literatura:
- Brzozowski S. M., Ramotowska F., Polski Słownik Biograficzny, tom XXX, Wydawnictwo PAN, Wrocław-Warszawa-Kraków-Gdańsk, 1987
- Chodkowski A. (red.), Encyklopedia muzyki, Wydawnictwo Naukowe PWN, Warszawa, 1995, str. 115
- Cottman E. W., Cold light brought into the classroom, Journal of Chemical Education, 14(5), 1937, str. 236
- Radziszewski B. R., Untersuchungen über Hydrobenzamid, Amarin und Lophin, Berichte der deutschen chemischen Gesellschaft, 10 (1), 1877, str. 70-75
- White E. H., Harding M. J. C., The Chemiluminescence of Lophine and Its Derivatives, Journal of the American Chemical Society, 86 (24), 1964, str. 5686-5687
- Ples M., Widmowy blask. Chemiluminescencja katalizowana kompleksem miedzi, Chemia w Szkole, 2 (2016), Agencja AS Józef Szewczyk, str. 13-17
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Emisja zimnego światła w czasie reakcji chemicznej zawsze przyciąga wzrok i wywołuje zainteresowanie widza, nie tylko adepta chemii. Oczywiście najlepszy efekt uzyskamy prowadząc doświadczenie w ciemności, co obrazuje mój film:
Dzięki łatwości syntezy, lofina doskonale nadaje się do roli pierwszego chemiluminoforu otrzymanego w pracowni każdego chemika.
Marek Ples






