Światło i barwa. Tionina jako barwnik fotochromowy
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (1/2019):

W ostatnich dekadach zawrotną karierę zrobiły tzw. materiały inteligentne. Łączą one własności czujnika i układu wykonawczego, reagują więc zmianą swoich właściwości w odpowiedzi na jakiś bodziec. Są wykorzystywane w wielu dziedzinach, poczynając od chirurgii, przez przemysł maszynowy i produkcję nowoczesnej odzieży, aż po astronautykę.
Chociaż istnienie wielu inteligentnych materiałów jest wynikiem złożonych procesów produkcyjnych, to niektóre z nich są na tyle nieskomplikowane – a przy tym ciekawe – że możemy pokusić się o ich otrzymanie w warunkach naszego laboratorium. Jednym z przykładów jest płyn zmieniający barwę w odpowiedzi na bodźce mechaniczne: po wstrząśnięciu niebieski (Fot.1A), a pozostawiony w spoczynku bezbarwny (Fot.1B) [1]. Istotną rolę w tym przypadku pełni pewien syntetyczny barwnik: błękit metylenowy C16H18ClN3S.
Inną klasą wspomnianych materiałów są substancje fotochromowe. Fotochromizm to zjawisko polegające na odwracalnej zmianie barwy związku chemicznego - lub bardziej skomplikowanego materiału - pod wpływem oświetlenia promieniowaniem elektromagnetycznym o odpowiedniej energii.
Fotochromizm wykorzystuje się np. przy produkcji nowoczesnych szkieł okularowych, samoczynnie zmieniających barwę: ciemnych w warunkach silnego nasłonecznienia, zaś przejrzystych w innych. W dzisiejszych czasach technika ich produkcji oparta jest najczęściej na odpowiednich sztucznych polimerach, których produkcja przekracza niestety najczęściej możliwości amatorskiej lub szkolnej pracowni chemicznej.
Jak zwykle sprawa nie jest jednak beznadziejna. Istnieje możliwość zapoznania się ze zjawiskiem fotochromizmu przy zastosowaniu prostszych sposobów. Jednym z nich jest wykorzystanie tioniny.
Doświadczenie
Przygotowanie doświadczenia jest na tyle nieskomplikowane, że nie powinno nastręczyć poważniejszych trudności. Musimy jednak zgromadzić potrzebne substancje:
- tionina C12H10N3S+,
- sól Mohra (NH4)2Fe(SO4)2,
- kwas siarkowy H2SO4.
Tionina nazywana też fioletem Lautha jest syntetycznym barwnikiem zbliżonym strukturalnie do wspomnianego uprzednio błękitu metylenowego. Wzór strukturalny kationu tioninowego przedstawia Rys.1.
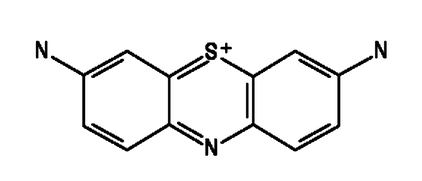
Tioninę wykorzystuje się najczęściej w postaci chlorku lub octanu. Tak czy inaczej, w warunkach normalnych substancja ta ma postać ciemnogranatowego, prawie czarnego proszku (Fot.2).
Omawiany związek z racji swoich właściwości jest dosyć powszechnie wykorzystywany do barwień biologicznych, np. w preparatyce mikroskopowej [2]. Tionina bywa też stosowana jako odtrutka po ekspozycji na duże dawki metali ciężkich [3].
Sól Mohra jest podwójną solą kwasu siarkowego(VI), żelaza(II) i amoniaku. Zwykle występuje w postaci heksahydratu (NH4)2Fe(SO4)2 · 6H2O tworzącego bladozielone kryształy o dużej rozpuszczalności w wodzie (Fot.3).
Sól Mohra ma pełnić w doświadczeniu rolę donora jonów żelaza(II) Fe2+. Wydawałoby się więc, że można ją zastąpić dowolną solą żelaza(II). Nie jest to niestety takie łatwe, ponieważ wspomniane jony są – szczególnie w roztworze – bardzo niestabilne i z łatwością ulegają utlenieniu do jonów żelaza(III) Fe3+. Sól Mohra, zarówno w postaci hydratu, jak i roztworu, jest jednak stosunkowo odporna na utlenianie. Powodem może być niekorzystny dla tego procesu odczyn roztworu, zapewniany przez hydrolizę jonów amonowych. Nawet jednak w tym przypadku roztwory soli powinny być przygotowywane w miarę możliwości na bieżąco. Substancja ta nie jest silnie toksyczna, ale posiada działanie drażniące – należy unikać jej kontaktu z powierzchnią naszego ciała.
Kwas siarkowy(VI) jest silnie żrący i należy nim posługiwać się z bardzo dużą ostrożnością.
Mimo, że w prezentowanym doświadczeniu nie operuje się dużymi ilościami niebezpiecznych substancji, to należy zachować daleko idącą ostrożność i stosować - jak zawsze przy pracy - odpowiednie środki ochrony osobistej.
Od tej chwili wszystkie czynności (poza wskazanymi) trzeba wykonywać przy niezbyt silnym świetle.
Przystępując do wykonania doświadczenia należy przygotować roztwór barwnika. Nie jest tu konieczna jakaś szczególna precyzja; wystarczy w niewielkiej ilości wody destylowanej rozpuścić tyle tioniny, by uzyskać ciemnogranatowy roztwór (Fot.4).
Następnie musimy przygotować (najlepiej na świeżo) roztwór 2,5g soli Mohra w 50cm3 wody destylowanej delikatnie zakwaszonej kwasem siarkowym(VI). Roztwór taki jest całkowicie bezbarwny (Fot.5) [4].
Potem do roztworu soli żelaza trzeba dodać taką ilość roztworu barwnika, by otrzymać niebieską, ale w dalszym ciągu przejrzystą ciecz (Fot.6). Uzyskanie dobrego rezultatu może wymagać dobrania stężenia barwnika.
Gotowy niebieski roztwór (Fot.7A) trzeba wystawić na działanie silnego światła widzialnego. Może być to żarówka żarowa, kompaktowa lub ledowa o dosyć dużej mocy. Po oświetleniu obserwuje się wtedy szybkie (kilka-kilkadziesiąt sekund) całkowite odbarwienie roztworu (Fot.7B). Po usunięciu źródła światła prawie natychmiast roztwór zaczyna się ponownie zabarwiać (Fot.7C), by po kilkudziesięciu sekundach powrócić do równie intensywnego co na początku koloru niebieskiego (Fot.7D).
Przedstawioną sekwencję zmian barwy można powtarzać wielokrotnie włączając i wyłączając oświetlenie. Skalując odpowiednio doświadczenie można je prezentować nawet przed dużym audytorium.
Wyjaśnienie
Fotochromizm opisanego roztworu jest spowodowany zachodzeniem interesującego procesu redoks. Jony żelaza(II) Fe2+ z łatwością ulegają utlenieniu do żelaza(III) Fe3+ co czyni je także dosyć wydajnymi reduktorami. Utlenianie kosztem tlenu obecnego w roztworze jest jednak utrudnione ze względu na jego stosunkowo małą dostępność, zarówno z racji stosunkowo niewielkiej koncentracji, jak i pH środowiska reakcyjnego. Po wzbudzeniu światłem jony Fe2+ zaczynają się jednak utleniać do Fe3+ kosztem cząsteczek barwnika, który tym samym zostaje zredukowany do bezbarwnego związku, czyli tzw. leukozasady. Obserwujemy to oczywiście jako odbarwienie się roztworu. W warunkach słabego oświetlenia bardziej korzystny termodynamicznie jest proces odwrotny, w wyniku czego leukotionina zostaje na powrót utleniona do formy barwnej. Odwracalność procesu nie jest jednak całkowita, ponieważ pula żelaza na drugim stopniu utleniania maleje w każdym cyklu zmiany barwy. Przy koncentracji wynikającej z podanych proporcji przygotowania roztworów zmiany barwne można jednak obserwować wystarczająco wiele razy – przynajmniej na potrzeby lekcji lub pokazów.
Literatura:
- [1] Ples M., Wrażliwe ciecze - odwracalne reakcje redoks z udziałem barwników, Chemia w Szkole, 1 (2015), Agencja AS Józef Szewczyk, str. 27-28 powrót
- [2] Thionin, w serwisie: http://stainsfile.info, dostępne online: http://stainsfile.info/StainsFile/dyes/52000.htm [dostęp: 5.01.2018] powrót
- [3] Seńczuk W., Toksykologia. Podręcznik dla studentów, lekarzy i farmaceutów, Wydawnictwo Lekarskie PZWL, Warszawa, 2002 powrót
- [4] Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Poniżej przedstawiam film ukazujący opisane zjawisko.
Marek Ples






