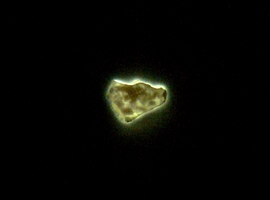
Chemiluminescencja fosforu
Z mroków alchemii
Wiele substancji wykazuje zdolność do chemiluminescencji, między innymi lucyferyna z lucyferazą, singletowa odmiana tlenu, lofina, układ pirogalol-formaldehyd, luminol, a nawet sód, będący przykładem metalu alkalicznego.
Chemiluminescencja została po raz pierwszy zaobserwowana przez niemieckiego alchemika Henniga Branda w 1669 roku. Otrzymał on białą odmianę alotropową fosforu i stwierdził, że substancja ta emituje zielonkawożółtą poświatę, doskonale widoczną w ciemności.
Dziś wiemy, że w tym przypadku świecenie jest efektem powolnego utleniania opisywanego pierwiastka.
Fosfor, jako pierwiastek, występuje w czterech odmianach alotropowych, różniących się właściwościami chemicznymi i fizycznymi:
- fosfor biały (A),
- fosfor czerwony (B),
- fosfor fioletowy (C),
- fosfor czarny (D).

Potrzebne substancje
Do doświadczenia potrzebujemy niewielkiej próbki fosforu białego. Z racji swojej reaktywności substancja ta musi być przechowywana pod wodą!
Ostrzeżenie: W tym doświadczeniu wykorzystywana jest, między innymi, biała postać alotropowa fosforu. Jest to substancja niezwykle toksyczna - dla dorosłej osoby dawka śmiertelna drogą doustną lub wziewną wynosi około 0,1g. Występuje też zagrożenie pożarowe, ponieważ rozdrobniony fosfor biały zapala się natychmiast, nawet w temperaturze pokojowej. Próbki czerwonego fosforu powinny być także traktowane nieufnie, ponieważ często zawierają one minimalną, ale w dalszym ciągu niebezpieczną, domieszkę fosforu białego. Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Niewielki, najwyżej centymetrowy, kawałek fosforu trzeba dosyć dokładnie osuszyć za pomocą bibuły i umieścić na niepalnej powierzchni, co widać na przedstawionych niżej zdjęciach.
Obserwacja w ciemności ujawnia, że fosfor biały, utleniany powierzchniowo tlenem atmosferycznym, przejawia dosyć wyraźnie widoczną chemiluminescencję o barwie żółtozielonkawej. Szczególnie wyraźnie uwidacznia się to na zdjęciach o wydłużonym czasie ekspozycji (ISO400, 15s):
Przy przeprowadzaniu doświadczenia konieczna jest duża ostrożność, nie tylko z powodu wspomnianych uprzednio właściwości toksycznych fosforu. Koniecznie trzeba pamiętać, że nawet podczas powolnego utleniania, próbka fosforu się rozgrzewa, co może prowadzić do samozapłonu. Płonący fosfor wytwarza temperaturę rzędu 1300°C i nie daje się ugasić wodą. Powstają wtedy także duże ilości duszącego, żrącego dymu, którego głównym składnikiem jest tlenek fosforu(V) P4O10.
A jeśli nie posiadamy białego fosforu? Nic nie stoi na przeszkodzie, by otrzymać niewielkiego jego ilości z fosforu czerwonego, który jest nietoksyczny i bardziej stabilny chemicznie niż odmiana biała.
W tym celu na dno probówki należy wsypać kilka mg fosforu czerwonego, a następnie napełnić ją dwutlenkiem węgla CO2 i zatkać dosyć ściśle zwitkiem waty szklanej. Dno probówki trzeba bardzo ostrożne ogrzewać płomieniem palnika, jednocześnie chłodząc jej ścianki wilgotną bibułą, według schematu:
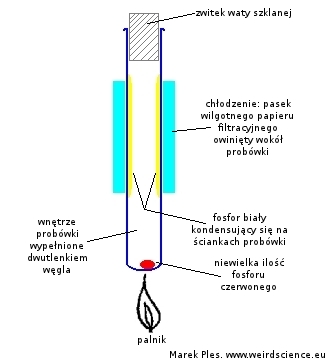
W podwyższonej temperaturze fosfor czerwony przekształca się w fosfor biały, którego pary kondensują na chłodzonej ściance probówki. Przed niekontrolowanym zapłonem chroni wypełniający wnętrze probówki dwutlenek węgla CO2.
Po ochłodzeniu probówki, należy wyciągnąć korek z waty szklanej, tak by umożliwić kontakt powstałego fosforu białego z tlenem atmosferycznym. W ciemności można wtedy wyraźnie zauważyć poświatę chemiluminescencji, co jest widoczne także na zdjęciu (ISO400, 10s):
Po wszystkich doświadczeniach fosfor należy przenieść z powrotem do naczynia z wodą, lub unieszkodliwić, na przykład przez spalenie w kontrolowanych warunkach albo wytrząsanie ze stężonym roztworem siarczanu(VI) miedzi(II) CuSO4, co prowadzi do powstania fosforku miedzi.
Wyjaśnienie
Emisja światła przez fosfor biały jest spowodowana przez jego utlenianie, o czym nas przekonuje fakt, że ustaje ona w warunkach beztlenowych. Reakcje chemiluminescencji zachodzą zwykle według schematu:
W wyniku reakcji substratu (lub substratów) X powstaje produkt przejściowy [Y]* występujący w stanie wzbudzonym. Wzbudzenie jest stanem o wysokiej energii, a przez to nietrwałym. Produkt przejściowy przekształca się więc spontanicznie w produkt ostateczny Y, o niższej energii. Nadwyżka energii przekształca się w energię promienistą hν.
W opisanych warunkach fosfor jest utleniany najpierw do mało lotnych, niższych tlenków fosforu o niezbyt dobrze poznanym składzie, a te są dalej utleniane do tlenku fosforu(V) P4O10. Właśnie ta reakcja jest odpowiedzialna za widoczne świecenie.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Bielański A., Chemia ogólna i nieorganiczna, PWN, Warszawa, 1981, str. 403,
- Rauhut M. M., Chemiluminescence w: Grayson M., Kirk-Othmer Concise Encyclopedia of Chemical Technology, wyd. III, John Wiley and Sons,
- Trzebiatowski W., Chemia nieorganiczna, Wyd. VIII, PWN, Warszawa, 1978, str. 261,
- Weeks M. E., The discovery of the elements. XXI. Supplementary note on the discovery of phosphorus, Journal of Chemical Education, 10 (5), 1933, str. 302.
Marek Ples