Chemiluminescencja luminolu w rozpuszczalniku organicznym
Chemiczna latarka
Wiele substancji wykazuje zdolność do chemiluminescencji, między innymi lucyferyna z lucyferazą, biały fosfor, singletowa odmiana tlenu, lofina czy układ pirogalol-formaldehyd. Najsilniejszą luminescencję daje utleniany w środowisku alkalicznym luminol. Trzeba jednak zaznaczyć, że woda jest silnym inhibitorem chemiluminescencyjnych właściwości luminolu. Z tego powodu w reakcjach prowadzonych w środowisku wodnym konieczne jest użycie energicznego utleniacza, na przykład nadtlenku wodoru H2O2, oraz odpowiednich katalizatorów, jak choćby związków kompleksowych żelaza (w tym znajdującej się w krwi kręgowców hemoglobiny) lub miedzi. W pewnych rozpuszczalnikach organicznych reakcja zachodzi dużo efektywniej. Emisja pięknego, niebiesko-zielonego światła nie trwa wtedy jedynie kilka sekund, jak w przypadku roztworów wodnych, lecz nawet kilka godzin!
Potrzebne substancje
By móc przeprowadzić doświadczenie potrzebujemy:
- dimetylosulfotlenek (DMSO) C2H6OS,
- wodorotlenek potasu KOH,
- luminol (hydrazyd 3-aminoftalowy) C8H7N3O2.
Ostrzeżenie: W tym doświadczeniu wykorzystywany jest wodorotlenek potasu, który jest mocną zasadą i ma silne działanie żrące. Luminol ma działanie alergogenne i jest podejrzewany o właściwości rakotwórcze! Należy bezwzględnie unikać zanieczyszczenia oczu lub skóry! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Wodorotlenek potasu KOH można zastąpić wodorotlenkiem sodu NaOH, zaś w razie braku dimetylosulfotlenku C2H6OS zamiennie wykorzystać dimetyloformamid C3H7NO, jednak otrzymany efekt może być nieco słabszy.
Wszystkie użyte substancje, a także naczynie, w którym będzie przeprowadzana reakcja, muszą być bezwzględnie suche! Nawet ślad wilgoci może uniemożliwić otrzymanie pożądanych wyników.
3-aminohydrazyd kwasu ftalowego, bardziej znany jako luminol, jest niestety stosunkowo drogim odczynnikiem. Na szczęscie jednak są potrzebne bardzo małe jego ilości, więc nawet pół grama tej substancji wystarczy do przeprowadzenia wielu ciekawych reakcji. Jego wzór strukturalny:
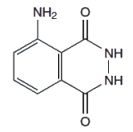
Można go też samemu zsyntezować, lecz wymaga to nieco zachodu. Dla chcącego nie ma nic trudnego! Dla tych, którzy chcieliby samodzielnie uzyskać tę substancję, zamieszczam opis przeprowadzonej przeze mnie syntezy luminolu. Poniżej zdjęcie próbki otrzymanego w ten sposób związku, który został wykorzystany także w tym doświadczeniu.
Sposób przeprowadzenia
W kolbie umieszczamy 25cm3 dimetylosulfotlenku C2H6OS, 0,5g wodorotlenku potasu KOH oraz niewielką ilość (na końcu szpatułki) luminolu. Zawartość kolby trzeba następnie bardzo intensywnie wytrząsać. Po pewnym czasie, od kilku do kilkudziesięciu sekund, mieszanina zaczyna jasno świecić.
Barwa emitowanego światła jest niebiesko-zielona, nieco inna niż w przypadku wodnego roztworu luminolu.
Czas świecenia roztworu może dochodzić do kilku godzin. Jasność światła jest tak duża, że z łatwością umożliwia czytanie druku, jak to widać poniżej:
Dla zainteresowanych dodam, że książka to "Zew krwi" Jacka Londona.
Wyjaśnienie
Świecenie roztworu jest związane z utlenianiem luminolu w środowisku alkalicznym. Woda jest silnym inhibitorem tej reakcji, dlatego koniecznie jest użycie energicznego utleniacza (np. H2O2 lub KMnO4) oraz odpowiednich aktywatorów. Dodatkowo wydajność kwantowa chemiluminescencji wynosi wtedy maksymalnie 0,001, co oznacza, że zaledwie jedna na tysiąc utlenianych cząsteczek luminolu staje się źródłem kwantów światła, a energia pozostałych rozprasza się w postaci ciepła. W pewnych rozuszczalnikach organicznych, na przykład w dimetylosulfotlenku, wydajność kwantowa tej reakcji jest jednak nawet dziesiątki razy wyższa, a dodatkowo zachodzi bez udziału żadnych aktywatorów, nawet pod wpływem tlenu atmosferycznego, wprowadzonego do roztworu podczas jego wytrząsania.
Życzę miłej i pouczającej zabawy:)
Marek Ples


