Kwiat pod mikroskopem
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (2/2022):

W naszych rozważaniach o roślinach wielokrotnie zajmowaliśmy się kwiatem, czy raczej kwiatami, towarzyszącym ich strukturom oraz ich przystosowaniom. Omawialiśmy zdolne do szybkich ruchów pręciki berberysu Berberis sp., łuski okrywy kocanek ogrodowych Xerochrysum bracteatum, olbrzymie i piękne kwiatostany tak często u nas spotykanego kasztanowca zwyczajnego Aesculus hippocastanum, czy nawet katapultującej swoje nasiona na duże – w stosunku do jej własnych wymiarów – iglicy zwyczajnej Erodium cicutarium [1] [2] [3] [4].
Kwiat, jako organ służący rozmnażaniu roślin, jest strukturą o wysokim stopniu złożoności. Traktuje się go jako skrócony pęd o ograniczonym wzroście na długość. Wykształcają się na nim elementy służące bezpośrednio lub pośrednio funkcjom rozmnażania płciowego. Kwiat roślin okrytonasiennych Magnoliophyta – pochodzących najprawdopodobnie od wspólnego przodka żyjącego w okresie karbonu, a więc 350–275 mln lat temu - jest organem homologicznym do sporofilu i sporofilostanu występujących u bardziej prymitywnych przedstawicieli królestwa roślin Plantae.
Piękno wielu kwiatów było powodem zachwytu najprawdopodobniej już od zarania rozumu u naszych przodków. Nabierały one często wagi symbolicznej, czy nawet religijnej. Przez większość naszej historii nie znaliśmy jednak celu i roli jaką pełnią kwiaty w życiu organizmów roślinnych – bywały uznawane nawet za swoistą igraszkę natury, rodzaj ornamentu czy ozdoby mającej upiększać naturę, ale nie posiadającej głębszego znaczenia. Dopiero Rudolf Jakob Camerarius – lekarz i botanik niemiecki - w końcu XVII wieku udowodnił eksperymentalnie, że kwiaty służą rozmnażaniu. Udało mu się także dojść roli poszczególnych, najważniejszych elementów kwiatu, bowiem stwierdził, że właściwymi organami odpowiedzialnymi za rozmnażanie są pręciki (jako generatywne organy męskie) i słupki (jako żeńskie). Kolejni badacze, wśród nich Carl Sprengel udowodnili, że w zapylaniu często uczestniczą owady, a także opisali szereg zjawisk związanych z procesem zapłodnienia u roślin, między innymi przedsłupność i przedprątność [5].
Kwiaty są tak złożonymi i interesującymi strukturami, że ich obserwacje nawet w przypadku łatwo dostępnych i wszędobylskich roślin – a często nawet chwastów – mogą dać nam wiele miłych w sensie poznawczym chwil. Dlatego tym razem chciałbym opowiedzieć Czytelnikowi o niepozornej roślinie jaką jest kurzyślad.
Kurzyślad polny
Kurzyślad polny Anagallis arvensis (spotyka też się nazwę Lysimachia arvensis) to gatunek rośliny należący do rodziny pierwiosnkowatych Primulaceae [6]. Jest dosyć szeroko rozpowszechniony, ponieważ występuje naturalnie w całej Europie, w dużej części Azji oraz w Afryce Północnej i Makaronezji [7]. W polskim środowisku należy traktować go jako archeofit. Jest pospolity i z łatwością można go spotkać zarówno na niżu, jak i w niższych położeniach górskich. Typowym siedliskiem tego gatunku są pola, ogrody, przydroża, wysypiska i winnice. Bywa określany jako roślina segetalna występująca w większości rodzajów upraw, ma jednak niewielką szkodliwość. Preferuje gleby gliniaste, bogate w azot i pozostałe składniki pokarmowe.
Kurzyślad polny jest drobną rośliną zielną, rozesłaną. Jej łodyga jest naga, płożąca i czterokanciasta, a jej długość dochodzi do około 10–20 cm. Pędy dosyć łatwo ulegają ukorzenieniu w kontakcie z glebą. Liście omawianej rośliny są ułożone naprzeciwległe, czasami w okółkach po 3–4 liście. Liście o długości do 3 cm, są siedzące, w kształcie jajowate, tępe lub niewyraźnie zaostrzone. Od spodu usiane niewielkimi ciemnymi gruczołkami.
Kurzyślad jest typową rośliną jednoroczną. Kwitnie w okresie od maja do października. Słupek i pręciki dojrzewają równocześnie, a kwiaty nie posiadają miodników, ponieważ są samopylne. Przejawia anemochorię – nasiona tej rośliny są rozsiewane przez wiatr.
Jeśli chodzi o kwiaty, to mają one zwykle średnicę około 8 mm i są barwy ceglastoczerwonej. Kwiaty są osadzone na dość długich szypułkach wyrastających w kątach liści. Płatki korony są najczęściej rozpostarte, na brzegu gruczołowato owłosione, na wierzchołku słabo karbowane. Działki kielicha są lancetowate i całobrzegie, niewiele krótsze od płatków korony. Pręciki możemy obserwować jako przyrośnięte do gardzieli, o nitkach równej długości, w górnej części pokrytych włoskami (fioletowymi lub rzadko białymi). Pylniki możemy ocenić jako 3–5 razy krótsze od nitek.
Wzór kwiatowy ma postać *K5[C(5)A5]G5, występuje słupek górny. Narys można zobaczyć na Rys.1.
Nocą i podczas pochmurnej pogody kwiaty zamykają się. Otwarte w porze porannej kwiaty kurzyśladu uznaje się przez to za zwiastun dobrej pogody.
Owoc kurzyśladu ma postać torebki otwierającej się wieczkiem.
Omawiana roślina bywa opisywana jako trująca, ponieważ zawiera różnego rodzaju saponiny, glikozydy, flawonoidy (kemferol C15H10O6, kwercetynę C15H10O7), garbniki, kwasy organiczne (kwas kawowy C9H8O4, ferulowy C10H10O4, synapinowy C11H12O5 i kumarowy C9H8O3) oraz gorycz glikozydową. W razie zjedzenia przez zwierzęta gospodarskie powoduje u nich zatrucia, których objawami są brak apetytu, biegunka, przyspieszony oddech i inne [10].
Warto zaznaczyć, że kurzyślad jest rośliną dnia długiego (obligatoryjną). Objawia się to tym, że wykształca kwiaty jedynie wtedy, kiedy długość czasu oświetlenia przekracza krytyczną wartość równą około 12 godzin na dobę [11]. Należy brać to pod uwagę chcąc uprawiać roślinę w warunkach sztucznych.
Płatki
Najbardziej interesującym dla nas elementem kwiatu w przypadku kurzyśladu będą płatki korony. Będziemy mogli zaobserwować zmiany w kształcie komórek epidermy tych organów podczas ich rozwoju, a także zapoznać się z kilkoma interesującymi technikami ich preparacji.
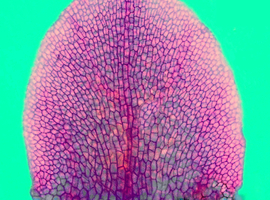
Pierwsze obserwacje warto przeprowadzić w odniesieniu do bardzo młodych, nie otwierających się jeszcze lub dopiero ledwie otwierających się pąków (Fot.3). Najlepiej jeśli płatki korony są jeszcze niewybarwione i mają zaledwie poniżej 1mm długości.
Płatki należy odciąć tuż przy podstawiue. Operacja ta wymaga stabilnej dłoni i dobrego oka – lub po prostu mikroskopu stereoskopowego – ale daje się przeprowadzić z powodzeniem. Wyizolowane płatki można poddać dalszej procedurze albo od razu, albo zakonserwować je w odpowiednim medium (np. w mieszaninie 70% etanolu C2H5OH, lodowatego kwasu octowego CH3COOH i 40% roztworu formaldehydu CH2O w stosunku objętościowym 90:5:5) i przechowywać dłuższy czas w lodówce [12].
Następnie zastosowano specyficzną technikę barwienia ścian komórkowych, tzw. metodę PAS (and. periodic acid–Schiff). Daje ona zabarwienie ścian na kolor fioletowy. Barwa ta powstaje wskutek redukcji bezbarwnej leukofuksyny do czerwono-fioletowego produktu, dzięki grupom aldehydowym powstałym w wyniku działania kwasem nadjodowym na polisacharydy tworzące ścianę komórkową. Odpowiednia procedura ma następujący przebieg:
- traktowanie płatków kwasem nadjodowym H5IO6 (20 minut) – użyto wodny roztwór kwasu o stężeniu 0,5%,
- płukanie wodą destylowaną (trzy razy po 10 minut) – w celu pozbycia się śladów kwasu nadjodowego,
- barwienie (30 minut, w ciemnosci) – próbki zostały zanurzone w odczynniku Schiffa (fuksyna C20H20N3 odbarwiona dwutlenkiem siarki SO2) na 30 minut,
- usuwanie nadmiaru nieprzereagowanego odczynnika Schiffa – płatki zostały przeniesione do wody siarkowej (10cm3 roztworu disiarczanu(IV) sodu 10% zmieszanego z 10cm3 kwasu solnego HCl o stężeniu 3,5%, a następnie rozcieńczonego do 200cm3 wodą destylowaną) na kilkanaście-kilkadziesiąt sekund, a potem wypłukane wodą destylowaną [13, zmienione].
Jeśli płatki zostały wcześniej zakonserwowane w opisanym utrwalaczu alkoholowo-octowo-formaldehydowym, to przed opisaną sekwencją czynności należy przeprowadzić jeszcze etap jego usunięcia i uwodnienia materiału. W tym celu pąki przenosi się kolejno do coraz bardziej rozcieńczonych wodą roztworów utrwalacza (w stosunku objętościowym kolejno 2:1, 1:1, 1:2), a następnie do wody destylowanej. Czas przebywania materiału w każdym roztworze należy dobrać eksperymentalnie.
Uzyskane w ten sposób wybarwione płatki można zatopić następnie (po odwodnieniu w rozpuszczalnikach organicznych) w odpowiedniej żywicy naturalnej albo syntetycznej między szkiełkami mikroskopowymi w celu dalszych obserwacji lub pominąć ten etap i obserwować je bezpośrednio po wykonanej procedurze.
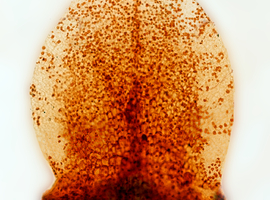
Tak wykonane preparaty można obserwować co prawda pod mikroskopem przy świetle widzialnym, ale najlepsze efekty da mikroskop fluorescencyjny (Fot.4).
Jak widać, sam płatek jest na wczesnym etapie rozwoju, a jego wymiary są mikroskopijne: całkowita długość płatka jest mniejsza niż 0,5mm. Możemy wtedy zaobserwować piękny układ komórek (a raczej ścian komórek) epidermy płatka – są one wieloboczne, o niezbyt skomplikowanym kształcie. Można zauważyć charakterystyczny, tzw. fontannowy układ komórek, których kolumny wyraźnie rozbiegają się coraz bardziej na boki oddalając się od podstawy płatka.
Metoda PAS wyraźnie uwidacznia ściany komórkowe. A gdybyśmy zechcieli zaobserwować jądra komórkowe? W tym celu musimy zastosować inne techniki. Chciałbym zaproponować dwie stosunkowo proste metody barwienia – podobne do siebie, ale wykorzystujące odmienne substancje chemiczne, a mianowicie fiolet gencjanowy (mieszanina fioletu krystalicznego C25H30N3Cl i fioletu metylowego C23H26N3Cl) i safraninę C20H19ClN4.
W tym celu pobrane świeżo płatki poddałem wytrawianiu w roztworze wodorotlenku sodu NaOH o stężeniu 5% w ciągu 24 godzin, po czym pięciokrotnie przepłukałem w wodzie destylowanej, pozostawiając je za każdym razem na okres jednej godziny. Następnie wykonałem płukanie w roztworze alkoholu etylowego o stężeniu 5%, 15% i 25%, pozostawiając płatki w każdym ponownie na jedną godzinę. W ostatnim roztworze płatki mogą być przechowywane w lodówce dłuższy czas, oczekując na właściwe barwienie.
Samo barwienie jest już mało kłopotliwe: płatki należy przenieść do roztworu barwnika (1% fioletu gencjanowego w 50% etanolu lub osobno 1,5% safraniny w 30% etanolu) na okres około 15 minut, po czym wypłukać 30% zimnym etanolem. Tak przygotowane płatki zamyka się w 50% wodnym roztworze glicerolu pod szkiełkiem nakrywkowym i obserwuje się natychmiast lub krótko potem – takie preparaty nie nadają się do dłuższego przechowywania.
Zarówno w przypadku barwienia fioletem gencjanowym (Fot.5) jak i safraniną (Fot.6) uzyskany efekt jest podobny.
W obu przypadkach możemy zaobserwować wybarwione (fioletowe w przypadku gencjany, czerwone jeśli użyto safraniny) jądra komórkowe. Brzeżnie niektóre komórki zostały zapewne uszkodzone mechanicznie lub chemicznie z powodu żrącego działania NaOH, dlatego nie obserwujemy w nich jąder komórkowych.
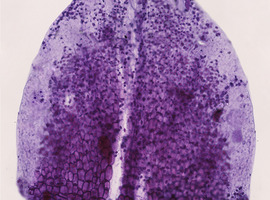
Po obserwacjach struktur we wczesnych stadiach rozwoju warto wypreparować także większe płatki. Dobrze w tym celu nadają się pąki tuż po otwarciu (Fot.7).
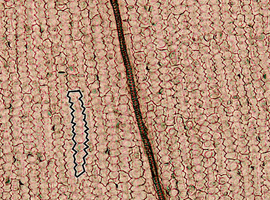
Płatek po kąpieli w roztworze wodorotlenku sodu (jak opisano uprzednio) lub nawet bezpośrednio, po zamknięciu w kropli wody możemy umieścić na stoliku mikroskopu świetlnego, stosując dosyć silne oświetlenie (Fot.8).
Obserwując komórki epidermy dojrzałego płatka, możemy stwierdzić, że mają one kształt znacząco odmienny niż na wcześniejszych etapach rozwoju – są bardziej wydłużone, a ich ściana komórkowa ulega znacznemu pofałdowaniu i przyjmuje bardzo charakterystyczny, harmonijkowy kształt.
Wyjaśnienie
Komórki roślinne - w przeciwieństwie do zwierzęcych - przez całe swoje życie są ściśle połączone z komórkami sąsiadującymi za pomocą blaszki środkowej zbudowanej głównie z pektyn. Struktura ta jest położona na zewnątrz pierwotnej ściany komórkowej. Z tego powodu komórki roślinne w czasie rozwoju nie są zdolne do przemieszczania się względem względem sąsiednich komórek, co nazywamy wzrostem symplastycznym. Wyjątki od tego schematu w świecie roślinnym są nieliczne. Z tego powodu kształt i budowa organów roślinnych ściśle zależy od sposobu wzrostu i podziału komórek formujących te organy. Tak jest oczywiście także w przypadku płatków korony kwiatu kurzyśladu polnego – porównując komórki płatka na różnych etapach rozwoju możemy zauważyć, że zmienił się ich kształt, ale wzajemny układ pozostał zachowany.
Myślę, że opisane obserwacje dowodzą, że nawet w przypadku tak niepozornej rośliny jaką jest kurzyślad, możemy poczynić wiele interesujących obserwacji i nauczyć się nowych technik preparowania materiału biologicznego.
Literatura
- [1] Ples M., Roślinny bokser? Szybkie ruchy pręcików berberysu, Biologia w Szkole, 3 (2020), Forum Media Polska Sp. z o.o., str. 81-85 powrót
- [2] Ples M., A jednak się porusza! Ruchy higroskopowe roślin, Biologia w Szkole, 3 (2016), Forum Media Polska Sp. z o.o., str. 52-56 powrót
- [3] Ples M., Kasztanowiec - zwyczajny, ale niezwykły, Biologia w Szkole w Szkole, 4 (2017), Forum Media Polska Sp. z o.o., str. 56-61 powrót
- [4] Ples M., Iglica pospolita - roślinna katapulta i ruchliwe nasiona, Biologia w Szkole, 5 (2020), Forum Media Polska Sp. z o.o., str. 54-57 powrót
- [5] Szafer W., Szaferowa J., Kwiaty w naturze i sztuce, Państwowe Wydawnictwo Naukowe PWN, Warszawa, 1958 powrót
- [6] Kadereit J. W., Albach D. C., Ehrendorfer F., Galbany-Casals M., Which changes are needed to render all genera of the German flora monophyletic?, Willdenowia, 46, 2016, str. 39-91 powrót
- [7] Germplasm Resources Information Network (GRIN), dostępne online: https://www.ars-grin.gov/ [dostęp: 03.02.2022] powrót
- [8] Kebert T., Floral diagram generator, dostępne online: http://kvetnidiagram.8u.cz/ [dostęp 02.02.2022] powrót
- [9] De Craene L. P. R., An Aid to Understanding Flower Morphology and Evolution, Cambridge University Press 2010 powrót
- [10] Mowszowicz J., Przewodnik do oznaczania krajowych roślin trujących i szkodliwych, Państwowe Wydawnictwa Rolnicze i Leśne, Warszawa, 1982, str. 221 powrót
- [11] Freyre R., Anagallis monelli plant named 'Wilcat Mandarin' , United States Patent Application, 2007 powrót
- [12] Broda B., Metody histochemii roślinnej, Państwowy Zakład Wydawnictw Lekarskich, 1971 powrót
- [13] Mikroskopia - Odczynnik Schiffa (broszura zestawu do barwienia firmy Sigma Aldrich), dostępne online: https://www.merckmillipore.com/PL/pl/product/PAS-staining-kit,MDA_CHEM-101646#documentation [dostęp: 02.02.2022] powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples