Białko - budulec życia
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (2/2017):

Interesujące jest, że mimo tysięcy lat rozwoju kultury i niezliczonych wysiłków filozofów oraz naukowców w dalszym ciągu nie udało się sformułować nie budzącej wątpliwości definicji tak ważnego, przynajmniej z naszego punktu widzenia zjawiska, jakim jest życie.
Najczęściej pojęcie życia określa się na dwa, wzajemnie uzupełniające się sposoby. Po pierwsze definiuje się je jako zespół tzw. procesów życiowych, będących wysoko zorganizowanym zbiorem przemian fizycznych i reakcji chemicznych. Zachodzą one w układach nazywanych organizmami i otwartych z punktu widzenia termodynamiki, tj. zdolnych zarówno do wymiany materii, jak i energii z otoczeniem. Organizmy są zbudowane hierarchicznie, składają się z różnej liczby komórek (co najmniej z jednej) i uczestniczą w często bardzo złożonych procesach biologicznych [1]. Po drugie, życie definiuje się jako właściwość swoistą dla układów, w których zachodzą wspomniane uprzednio procesy [2].
Zastanawiając się nad definicją życia zwykle dosyć szybko napotykamy pewien istotny problem. Życie po części jest procesem, a nie tylko pewną cechą skomplikowanych układów fizykochemicznych. Dodatkowo definicja życia powinna być wystarczająco ogólna, tak by można było w niej sklasyfikować wszystkie znane nam organizmy żywe, które są przecież tak różnorodne [3].
Życie możemy też zdefiniować opisowo jako właściwość układu (organizmu), który wykazuje następujące cechy [4]:
- Homeostaza, czyli zdolność do regulacji środowiska wewnętrznego w taki sposób, aby utrzymywać stałość jego parametrów.
- Metabolizm, czyli całokształt reakcji chemicznych i związanych z nimi przemian energii zachodzących w komórkach składających się na żywy organizm. Procesy metaboliczne można podzielić na anaboliczne (reakcje syntezy) i kataboliczne (reakcje rozkładu).
- Hierarchia, czyli składanie się z jednej lub więcej komórek, będących podstawowymi jednostkami strukturalnymi i funkcjonalnymi organizmów żywych.
- Wzrost, czyli zdolność do utrzymywania poziomu anabolizmu na wyższym poziomie niż katabolizm.
- Adaptacja, czyli umiejętność organizmu polegająca na przystosowywaniu się do nowych warunków wraz z upływem czasu.
- Pobudliwość, czyli zdolność do reagowania na bodźce, zarówno docierające do organizmu ze środowiska zewnętrznego, jak i wewnętrznego.
- Rozmnażanie, czyli umiejętność wytwarzania nowych pokoleń organizmów.
Zauważmy, że według tej definicji np. wirusy, chociaż wykazują pewne cechy istot żywych (np. zdolność do powielania się i adaptacji) to jednak nie są one organizmami żywymi, ponieważ nie posiadają budowy komórkowej i nie prowadzą własnych procesów metabolicznych.
Czasem stosuje się też redukcjonistyczną definicję życia, mówiącą, że życie jest systemem albo zbiorem elementów zdolnych do ewolucji w sensie biologicznym. Niektórzy badacze zarzucają jej jednak przesadną ogólność, ponieważ w jej myśl żywe są np. niektóre programy komputerowe. Dobrym przykładem jest tutaj system Tierra [5].
Wszystkie organizmy żywe, jakie znamy mają w zasadzie podobny skład chemiczny. Najważniejszymi pierwiastkami koniecznymi do istnienia ziemskiego życia są węgiel C, wodór H, azot N, tlen O, fosfor P oraz siarka S. Razem tworzą różnego rodzaju związki organiczne potrzebne do życia, m.in. kwasy nukleinowe, cukry i tłuszcze. Równie ważną klasą substancji są tutaj białka nazywane też proteinami.
W niniejszym artykule chciałbym przybliżyć szanownemu Czytelnikowi pewne zagadnienia na temat znaczenia białek, ich budowy i prostych sposobów wykrywania obecności tych substancji w materiale biologicznym.
Białka – niezwykłe substancje
Białka są wielkocząsteczkowymi biopolimerami czy raczej biopolikondensatami zbudowanymi z reszt aminokwasów połączonych ze sobą wiązaniami peptydowymi -CONH- (Rys.1).
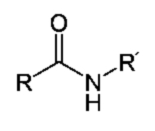
Wiązanie peptydowe łączy grupę α-aminową jednego aminokwasu z grupą α-karboksylową drugiego aminokwasu.
Aminokwasy będące elementami składowymi białek są grupą organicznych związków chemicznych zawierających zasadową grupę aminową oraz kwasową grupę karboksylową [6]. W skład naturalnych białek wchodzi 20 aminokwasów: alanina, arginina, asparagina, cysteina, fenyloalanina, glicyna, glutamina, histydyna, izoleucyna, kwas asparaginowy, kwas glutaminowy, leucyna, lizyna, metionina, prolina, seryna, treonina, tryptofan, tyrozyna i walina.
Zwykle liczba reszt aminokwasowych pojedynczego łańcucha białkowego jest większa niż 100. Czasem białko bywa zbudowane z wielu łańcuchów nazywanych podjednostkami.
Synteza białek odbywa się w komórkach przy udziale specjalizowanych struktur - rybosomów [7].
Strukturę białka można opisywać na czterech hierarchicznych poziomach:
- Struktura pierwszorzędowa białka – kolejność aminokwasów w łańcuchu polipeptydowym.
- Struktura drugorzędowa białka – przestrzenna organizacja fragmentów łańcuchów polipeptydowych. Do struktur drugorzędowych zaliczane są:
- helisa alfa (ang. α-helix)
- harmonijka beta (ang. β-sheet)
- zakręt/zwrot beta (ang. β-hairpin)
- Struktura trzeciorzędowa białka – wzajemne położenie elementów struktury drugorzędowej. Warunkują ją zróżnicowane wiązania chemiczne oraz oddziaływania międzycząsteczkowe: mostki disiarczkowe, oddziaływania jonowe, oddziaływania hydrofobowe i oddziaływania van der Waalsa.
- Struktura czwartorzędowa białka – wzajemny układ w przestrzeni oraz sposób wiązania się podjednostek białka lub grup prostetycznych (białka złożone).
Funkcje białek są bardzo różnorodne. Niektóre z nich są substancjami budulcowymi, pełnią więc funkcję strukturalną. Wspomnieć tu należy nie tylko o budujących określone struktury keratynie, elastynie i kolagenie, ale także np. o odpowiadających za przyleganie do siebie komórek kadherynach. Inne, jak wchodzące w skład mięśni aktyna i miozyna, umożliwiają uporządkowany ruch organizmu. Za transport określonych substancji w obrębie organizmu odpowiada np. hemoglobina i transferryna, za odpowiedź immunologiczną natomiast m.in. immunoglobuliny. Bardzo ważnym obszarem działania białek jest szeroko pojęta regulacja procesów biochemicznych zachodzących w organizmie, od zmian w przepuszczalności błon biologicznych, aż po regulację wzrostu i różnicowania. Nieoceniony jest tu udział enzymów, będących biologicznymi katalizatorami. Wykazują one zdolność do przyspieszania różnorodnych reakcji, stanowiących chemiczną stroną zjawiska nazywanego przez nas życiem [8].
Białka występują powszechnie w świecie materii ożywionej. Jak jednak wykazać ich obecność i specyficzne właściwości? Na szczęście istnieje wiele metod – w następnym rozdziale postaram się przybliżyć kilka z nich. Starałem się dokonać takiego wyboru, by nie wymagały one specjalnego sprzętu ani drogich odczynników.
Wykrywamy białka i aminokwasy
Chcąc przystąpić do doświadczeń musimy się zaopatrzyć w wygodne źródło białka. Odpowiednia będzie tu owoalbumina występująca w jajach, np. kurzych. Do doświadczenia należy więc białko jaja kurzego rozcieńczyć wodą destylowaną około dziesięciokrotnie i przesączyć. Powstały roztwór jest lekko żółtawy (Fot.1) i nie można go zbyt długo przechowywać.
Przenieśmy nieco roztworu białka do probówki (Fot.2). Dla uwidocznienia oczekiwanych zmian probówkę najlepiej umieścić na ciemnym tle.
Do probówki należy następnie dodać kilka kropli alkoholu etylowego C2H5OH o stężeniu przynajmniej 70% i zamieszać. Efekt jest natychmiastowy – próbka białka mętnieje (Fot.3).
Jeśli zdekantujemy lub odsączymy osad i przeniesiemy go do wody destylowanej, to nie nastąpi ponowne jego rozpuszczenie. Obserwowana zmiana jest więc nieodwracalna.
Obserwowane zjawisko jest nazywane denaturacją białka. Polega ona na powstaniu pod wpływem pewnych czynników zmian w II-, III- i IV-rzędowej strukturze białek, przy zachowaniu ich sekwencji aminokwasowej. Zmianie ulegają właściwości chemiczne i fizyczne białka, m.in. jego rozpuszczalność. Obserwuje się wtedy często procesy agregacji i wytrącania, co zanotowaliśmy właśnie w tym przypadku.
Czynniki denaturujące mogą być zarówno pochodzenia fizycznego, jak i chemicznego. Do pierwszych można zaliczyć ogrzewanie powyżej określonej temperatury (nazywanej temperaturą denaturacji), silne mieszanie, wytrząsanie, wystawienie na działanie promieniowania UV, a także na ultradźwięki o odpowiednio dużym natężeniu. Wśród czynników chemicznych można wymienić działanie wielu alkoholi (m.in. etylowego), soli metali ciężkich, silnych kwasów i zasad, chlorku guanidyny CH6ClN3 i innych substancji.
Denaturujące właściwości alkoholu etylowego mają pewne zastosowania praktyczne. To właśnie m.in. właśnie im ta substancja zawdzięcza właściwości antybakteryjne. Śmierć bakterii jest skutkiem denaturacji białek wchodzących w skład ich komórek, a w szczególności błony komórkowej.
Poza denaturacją istnieje też podobne zjawisko, czyli tzw. wysalanie białek. W tym przypadku białka wytrącają się z roztworu pod wpływem roztworów soli metali lekkich i amonu. Najważniejszą różnicą jest to, że proces ten jest odwracalny, tj. po przeniesieniu osadu wytrąconego białka do roztworu nie zawierającego czynnika wysalającego (ani denaturującego) nastąpi ponowne rozpuszczenie się białka. Nie dochodzi tu do uszkodzenia struktury łańcuchów, a zjawisko jest efektem zaburzenia otoczki solwatacyjnej i agregacji cząsteczek białek.
Przejdźmy jednak do reakcji charakterystycznych, o jakich możemy mówić w odniesieniu do białek. Jedną z ważniejszych jest reakcja biuretowa.
Reakcja biuretowa została opisana pierwotnie przez Ferdinanda Rosego w roku 1833 [9]. Nieco ponad 20 lat później niezależnie opisał ją polski fizjolog Gustaw Piotrowski i dlatego bywa ona nazywana także reakcją Piotrowskiego [10].
Reakcja biuretowa pozwala na wykrywanie wiązań peptydowych w zróżnicowanych związkach organicznych, głównie w białkach.
Do przygotowania odczynnika potrzebujemy:
- siarczan(VI) miedzi(II), pentahydrat CuSO4·5H2O
- wodorotlenek sodu NaOH
- winian potasu-sodu (sól Seignette’a) KNaC4H4O6
Wodne roztwory wodorotlenku sodu NaOH są silnie żrące. Nie wolno dopuścić do ich kontaktu z powierzchnią ciała.
Aby otrzymać odczynnik należy 0,75g niebieskich kryształów uwodnionego siarczanu(VI) miedzi(II) CuSO4·5H2O rozpuścić w 50cm3 wody destylowanej, a następnie dodać 10cm3 wodnego roztworu wodorotlenku sodu NaOH (Cp=50%). Powstaje przy tym duża ilość niebieskiego osadu wodorotlenku miedzi(II) Cu(OH)2. Następnie trzeba do roztworu dodać 2,5g winianu potasu-sodu KNaC4H4O6 i mieszać intensywnie. Dochodzi do roztworzenia osadu i powstaje klarowny roztwór winianowego kompleksu miedzi. Ostatnią rzeczą jaką trzeba zrobić jest dopełnienie objętości roztworu wodą destylowaną do 100cm3. Gotowy odczynnik biuretowy odznacza się piękną intensywnie niebieską barwą (Fot.4).
Odczynnik jest trwały i można go przechowywać przez dłuższy czas w zamkniętym naczyniu.
Reakcja biuretowa bierze swoją nazwę od biuretu będącego pochodną mocznika CO(NH2)2. Mocznik jest końcowym produktem przemian białek i innych związków azotowych w organizmach zwierząt ureotelicznych - jest wydalany głównie z moczem, w niewielkich ilościach też z potem. W stanie czystym stanowi białą substancję krystaliczną (Fot.5).
Mocznik w podwyższonej temperaturze ulega reakcji kondensacji dając w efekcie dimer, czyli biuret H2NC(O)NHC(O)NH2 według równania reakcji przedstawionego na Rys.2.
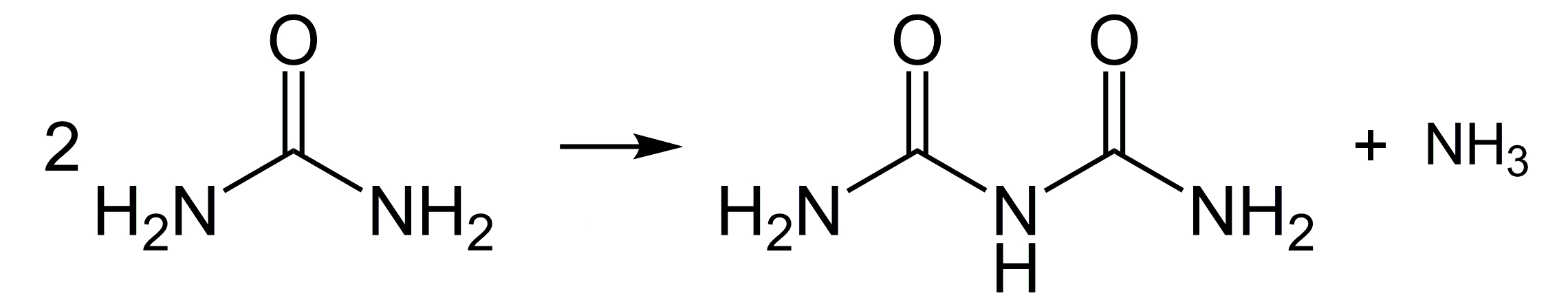
Biuret nie zalicza się oczywiście do białek, ale dzięki swojej budowie jest najprostszym związkiem chemicznym ulegającym reakcji biorącej od niego nazwę. Możemy się o tym dosyć łatwo przekonać.
W dwóch probówkach należy umieścić po kilka centymetrów sześciennych odczynnika biuretowego. Do pierwszej z nich dodajmy szczyptę mocznika, zaś do drugiej podobną ilość biuretu (powstałego przez ogrzanie mocznika). Ciecz w obu probówkach należy zamieszać aż do rozpuszczenia badanych substancji.
Praktycznie natychmiast można dokonać interesującej obserwacji. Ciecz w probówce z dodatkiem mocznika zachowuje naturalną, błękitną barwę odczynnika biuretowego. W drugiej zaś możemy zaobserwować wyraźną zmianę barwy na fioletową, co uznajemy za pozytywny wynik próby (Fot.6). Jak widzimy, mocznik nie daje w tym przypadku żadnego efektu, w przeciwieństwie do jego dimeru.
Odczynnik biuretowy miał nam jednak posłużyć do wykrywania białka. Posłużymy się wykorzystywanym już uprzednio roztworem białka jaja kurzego. Próbę kontrolną stanowić będzie odczynnik biuretowy bez dodatku białka (Fot.7A). Do drugiej probówki zawierającej podobną ilość odczynnika biuretowego wystarczy dodać dosłownie kilka kropli roztworu białka, by ten przybrał bardzo intensywną barwę fioletową, w tym przypadku o wiele intensywniejszą niż w wyniku poprzedniej próby z biuretem (Fot.7B).
Zmiana barwy jest spowodowana powstawaniem związków kompleksowych, w których dwudodatni jon miedzi Cu2+ jest kompleksowany przez co najmniej dwie grupy peptydowe [11].
Reakcję biuretową można stosować w analizie jakościowej i ilościowej. W tym drugim przypadku wykorzystuje się zależność intensywności barwy roztworu od koncentracji białka.
Reakcję biuretową stosuje się m.in. w celu sprawdzenia obecności wolnego białka w płynach ustrojowych, np. we krwi. Obecność dużych ilości takiego białka może wskazywać na poważne uszkodzenia narządów wewnętrznych.
Inną reakcją charakterystyczną dla białek jest reakcja ksantoproteinowa (gr. ksanthós – żółty). Spróbujemy za jej pomocą wykryć białko w twarogu (Fot.8). Wykorzystuje się w niej kwas azotowy(V) HNO3 (Cp=65%) i wodę amoniakalną NH3(aq). Pamiętajmy, że wspomniany kwas jest silnie żrący, a w czasie reakcji z jego udziałem może dochodzić do uwalniania trujących tlenków azotu. Z wody amoniakalnej natomiast uwalnia się gazowy amoniak NH3, który ma działanie drażniące, a w większych ilościach jest toksyczny. Zalecana jest ostrożność!
Grudkę twarogu umieśćmy w probówce (Fot.9A). Naturalna barwa twarogu jest oczywiście biała. Do probówki dodajmy następnie kilka centymetrów sześciennych kwasu azotowego(V) i delikatnie ogrzejmy. Praktycznie natychmiast twaróg przybiera jasnożółtą trwałą barwę (Fot.9B). Po usunięciu kwasu (np. pipetą pasteurowską) próbkę należy zwilżyć rozcieńczonym wodnym roztworem amoniaku, czyli wodą amoniakalną. Efektem będzie pogłębienie się barwy i jej zmiana na wyraźnie pomarańczową (Fot.9C). Opisane zmiany barw są charakterystyczne dla wszelkich ciał białkowych [12].
Istotą reakcji ksantoproteinowej jest nitrowanie reszt aminokwasów, w których budowie występują pierścienie aromatyczne (tyrozyna, tryptofan, fenyloalanina). Powstają przy tym pochodne nitrowe o charakterystycznej żółtej barwie (Rys.3).
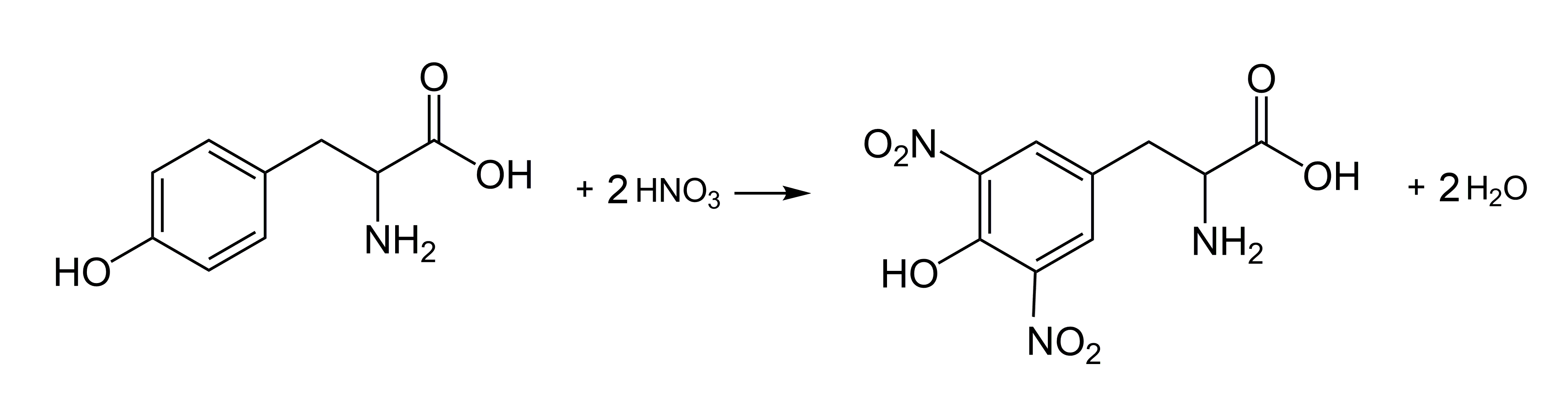
W środowisku zasadowym, np. pod wpływem amoniaku powstałe związki nitrowe przechodzą w intensywniej zabarwione pochodne.
Kolejną reakcją, jaką chciałbym przedstawić jest tak zwana próba ninhydrynowa. Jest to niezwykle czuła reakcja charakterystyczna pozwalająca wykrywać wolne grupy aminowe. Dzięki temu można oznaczać aminokwasy budujące białka zarówno jakościowo, jak i ilościowo.
Ninhydryna C9H6O4 jest organicznym związkiem chemicznym. W temperaturze pokojowej stanowi białą substancję krystaliczną. Jest szkodliwa dla zdrowia, dlatego należy unikać bezpośredniego kontaktu z tą substancją. Ninhydryna jest niezbyt dobrze rozpuszczalna w wodzie i alkoholach.
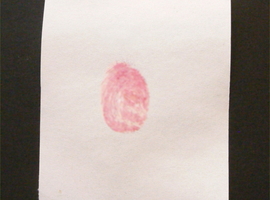
Omawiany związek znajduje wiele zastosowań przy badaniu obecności i oznaczaniu koncentracji aminokwasów. Wysoka czułość tej metody pozwoliła wykorzystać ją też w kryminalistyce w celu uwidaczniania odcisków palców. Aby się o tym przekonać przygotujmy kartkę papieru, na której odciśnijmy palec. Uzyskany w ten sposób odcisk jest oczywiście niewidoczny (Fot.10).
Papier należy następnie zwilżyć 0,1% roztworem ninhydryny w alkoholu i pozwolić wyschnąć. Na tym etapie w dalszym ciągu nie dostrzegamy żadnych zmian (Fot.11).
By uwidocznić odcisk palca należy delikatnie podgrzać próbkę materiału przy dostępie pary wodnej. Można w tym celu zastosować żelazko parowe ustawione na niezbyt wysoką temperaturę. Papier należy wtedy umieścić między dwiema warstwami bibuły. W razie wykorzystania żelazka nie posiadającego możliwości wytwarzania pary wodnej należy delikatnie zwilżyć wodą obie warstwy bibuły.
W toku takiego postępowania możemy bardzo szybko zauważyć pojawianie się obrazu linii papilarnych tworzących obraz odcisku palca. Barwa powstającego obrazu jest czerwona (Fot.12).
Mechanizm tej reakcji jest dosyć skomplikowany. Aminy pierwszorzędowe, do których należą m.in. aminokwasy w reakcji z ninhydryną tworzą tzw. zasadę Schiffa. Związek ten następnie ulega rozpadowi. Powstała pochodna reaguje potem z kolejną cząsteczką ninhydryny, tworząc kolejną zasadę Schiffa o intensywnej barwie, tzw. purpurę Ruhemanna [13].
Na skórze, np. na skutek wydzielania potu zawsze znajdują się niewielkie ilości białek i aminokwasów. Ich ilość jest wystarczająca, byśmy mogli je wykryć za pomocą opisanej metody.
Z roztworami ninhydryny należy zawsze pracować w rękawiczkach. Powodem jest tutaj nie tylko jej toksyczność, ale także łatwy do zrozumienia fakt, że pozostawia ona na skórze trudne do usunięcia plamy.
Podsumowanie
Nie będzie przesadą, jeśli powiem, że białka odgrywają zasadniczą rolę we wszystkich procesach biologicznych. Pełnią funkcję strukturalną. Jako enzymy biorą udział w katalizowaniu przemian w układach biologicznych - nadają więc kształt całemu metabolizmowi. Nie można też zapominać, że uczestniczą w transporcie zróżnicowanych cząstek, służą jako przeciwciała oraz biorą udział w przekazywaniu impulsów nerwowych.
Dzięki opisanym prostym doświadczeniom jest możliwe przybliżenie uczniom metod wykrywania białek, a także właściwości tych substancji. Myślę, że jest to przydatna z punktu widzenia dydaktyki możliwość.
Literatura:
- [1] Gánti T., Podstawy życia, Wiedza Powszechna, Warszawa, 1986, str. 76, 80 – 81 powrót
- [2] Chmurzyński J. A., W poszukiwaniu istoty życia, w: Organizm - jednostka biologiczna, Państwowe Zakłady Wydawnictw Szkolnych, 1977, str. 65 powrót
- [3] Nealson K. H., Conrad P. G., Life: past, present and future, Philosophical Transactions of the Royal Society B, 354 (1392), 1999, str. 1923 - 1929 powrót
- [4] Habitability and Biology: What are the Properties of Life?, w serwisie: http://phoenix.lpl.arizona.edu/, dostępne online: http://phoenix.lpl.arizona.edu/mars141.php [dostęp 28.01.2017] powrót
- [5] Bedau M. A., McCaskill J. S. i wsp., Open problems in artificial life, Artificial Life, 6 (4), 2000, str. 363 - 376 powrót
- [6] Mastalerz P., Chemia Organiczna, Wydawnictwo Naukowe PWN, Warszawa, 1986, str. 966 powrót
- [7] Berg J. M., Tymoczko J. L., Stryer L., Clarke N. D., Biochemia, Wydawnictwo Naukowe PWN, Warszawa, 2007 powrót
- [8] Ples M., Enzymy - biologiczne katalizatory, Chemia w Szkole, 3, 2016, Agencja AS Józef Szewczyk, str. 6 - 11 powrót
- [9] Rose F., Ueber die Verbindungen des Eiweiss mit Metalloxyden, Annalen der Physik und Chemie, 104 (5), 1833, str. 132 - 142 powrót
- [10] von Piotrowski G., Eine neue Reaction auf Eiweisskörper und ihre näheren Abkömmlinge, Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften, Mathematisch-Naturwissenschaftliche Classe, 24, 1857, str. 335 - 337 powrót
- [11] Freeman H. C. , Smith J. E. W. L., Taylor J. C., Crystallographic studies of the biuret reaction. I. Potassium bis-biuret cuprate(II) tetrahydrate, K2[Cu(NHCONHCONH)2]·4H2O, Acta Crystallographica, 14, 1961, str. 407 - 418 powrót
- [12] Sękowski S., W kręgu azotu (z cyklu: Chemia na co dzień), Młody Technik, 11 (208), 1965, str. 112 - 115 powrót
- [13] Wigfield D. C., Buchanan G. W., Croteau S. M., On Ruhemann's Purple, Canadian Journal of Chemistry, 58 (3), 1980, str. 201 - 205 powrót
Wszystkie fotografie i schematy zostały wykonane przez Autora.
Marek Ples