Chemiluminescencja tlenu singletowego

Świecący gaz
Tlen jest gazem występującym w postaci dwuatomowych cząsteczek. Dla O2 stanem podstawowym jest forma trypletowa (3O2). Cząsteczka z wszystkimi sparowanymi elektronami (forma singletowa 1O2) jest w stanie wzbudzonym, o wyższej energii. Jest to bardzo nietypowa sytuacja, ponieważ w przypadku innych pierwiastków jest zwykle odwrotnie. Stan singletowy jest nietrwały i może spontanicznie przejść w tripletowy. Różnica energii jest oddawana do środowiska w formie promieniowania. Dochodzi więc do chemiluminescencji.
By to sprawdzić wytworzymy niewielkie ilości tlenu w stanie singletowym.
Czego potrzebujemy?
Tym razem potrzebujemy kilku dosyć niebezpiecznych odczynników:
- Nadtlenek wodoru H2O2 30% (perhydrol),
- wodorotlenek sodu NaOH,
- chlor Cl2.
Ostrzeżenie: W tym doświadczeniu wykorzystuje się NaOH, który jest mocną zasadą i ma silne działanie żrące. Perhydrol jest także żrący; w zetknięciu ze skórą wywołuje zmiany martwicze. Należy bezwzględnie unikać zanieczyszczenia oczu lub skóry! Konieczne jest stosowanie rękawic i okularów ochronnych! Chlor jest silnie trujący, doświadczenie trzeba prowadzić pod wyciągiem lub na zewnątrz! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Trzeba bezwzględnie przestrzegać powyższych środków bezpieczeństwa! Lepiej nie ignorować tych ostrzeżeń, bo może się to skończyć trwałym kalectwem lub śmiercią.
Jeśli chodzi o chlor to najwygodniej byłoby go pozyskiwać z odpowiedniej butli gazowej. W razie braku chloru można go wytworzyć w reakcji KMnO4 z kwasem solnym lub przez elektrolizę tego kwasu.
Doświadczenie
Najpierw musimy sporządzić roztwór wodorotlenku sodu. W 35cm3 wody destylowanej należy rozpuścić 5g NaOH. W innej zlewce odmierzamy 7,5cm3 H2O2. Oba roztwory musimy schłodzić do temperatury 2-4°C.
Kiedy roztwory będą odpowiednio schłodzone to należy je zlać razem i szybko wymieszać. Następnie przez roztwór przepuszczamy strumień chloru. Chlor najlepiej dostarczać rurką z wąskim ujściem. Można w tym celu wykorzystać szklaną pipetę pasteurowską, tak jak na poniższym zdjęciu:
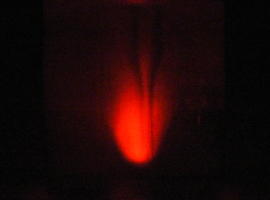
Po zaciemnieniu laboratorium możemy z łatwością dostrzec jasnoczerwoną poświatę powstającą wokół strumienia chloru. Przebieg doświadczenia został uwidoczniony na moim filmie:
Zdjęcia przy wydłużonym czasie ekspozycji pozwalają docenić piękno tego zjawiska:
Doświadczenie można też przeprowadzić inaczej. Alkaliczny roztwór nadtlenku wodoru należy wlać wtedy do butelki, a chlor wprowadzić nad powierzchnię cieczy. Chlor jest cięższy od powietrza, więc wypełniając naczynie powoduje wyparcie z niego powietrza. W czasie wytrząsania mieszanina rozbłyskuje jasnym światłem:
Wyjaśnienie
W silnie zasadowym roztworze wodorotlenku sodu i nadtlenku wodoru dochodzi do reakcji z chlorem, dzięki czemu powstaje podchloryn:
Następnie nadtlenek wodoru reaguje z jonem podchlorynowym dając w wyniku jon nadtlenochlorowy:
Jon nadtlenochlorowy jest bardzo nietrwały i szybko rozpada się na cząsteczkę tlenu i jon chlorkowy:
Powstały tlen zgodnie z zasadą zachowania spinu jest w stanie singletowym. Stan wzbudzony tlenu 1O2 jest nietrwały. Oddaje on energię promienistą o długości fali równej 634nm (światło czerwone), a sam przekształca się w stan trypletowy 3O2 o niższej energii.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Bartosz G., Co to są reaktywne formy tlenu? w: Druga twarz tlenu, Wyd. II, Wydawnictwo Naukowe PWN, Warszawa, 2008, str. 19,
- Laingl M., The Three Forms of Molecular Oxygen, Journal of Chemical Education, 66 (6), 1989, str. 453-455,
- Pinto G., Rohrig B., Use of chloroisocyanurates for disinfection of water, Journal of Chemical Education, 80(1), 2003, str. 41–44,
- Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, 2001, str. 161-163.
- Schweitzer C., Schmidt R., Physical Mechanisms of Generation and Deactivation of Singlet Oxygen Chemical Reviews 103 (5), 2003, str 1685–1757
Marek Ples