Dwa kwasy - proste reakcje oscylacyjne i zaskakujące powiązania
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (6/2020):

Świat jest piękny, wystarczy tylko rozejrzeć się wokół. Za potwierdzenie tej – wydawałoby się banalnej – konstatacji może służyć przedstawione zdjęcie, które wykonałem spiesząc się pewnego razu na pociąg (Fot.1). Ponad industrialnym, okołodworcowym krajobrazem rozciąga się interesująca formacja chmur, zaróżowiona przez wschodzące dopiero Słońce. Obraz ten kryje jednak w sobie pewną zagadkę, na którą zwróci z pewnością uwagę każdy umysł analityczny.
Spójrzmy na wspomniane chmury. Dlaczego formują one wyraźnie oddzielone od siebie pasma? Co sprawia, że w pewnych rejonach atmosfery dochodzi do ich powstania, podczas gdy w sąsiednich tak się nie dzieje? Pasma są położone na tyle blisko siebie, że początkowy skład atmosfery (przed powstaniem tej formacji) był w nich najprawdopodobniej bardzo zbliżony. W jaki sposób więc sam układ decyduje, gdzie ma powstać chmura, a gdzie nie?
Jak widać, nawet w drodze można znaleźć naukowe natchnienie i powody do rozmyślań. Piękno świata tkwi według mnie w fakcie, że to właśnie on stanowi największe i najwspanialsze laboratorium, jakie może sobie wymarzyć naukowiec.
Uwiecznione na fotografii chmury stanowią wspaniały - i trzeba przyznać, że całkiem okazały - przykład zjawiska samoorganizacji. Fenomen ten polega na spontanicznym powstawaniu w specyficznych warunkach uporządkowanych, czasami wręcz budzących wrażenie intencjonalnie ukształtowanych, struktur. Procesy, które do tego prowadzą mogą mieć charakter chemiczny, fizyczny lub mieszany. W przypadku wspomnianych chmur za powstawanie uporządkowania może odpowiadać np. falujący ruch powietrza oraz konwekcja, a także specyficzne rozmieszczenie zarodków kondensacji.
Zjawiska samoorganizacji są powszechne w naturze i prawdopodobnie pełnią doniosłą rolę w wielu procesach (także biologicznych). Skala zdarzeń, na które wpływ mają zjawiska samoorganizacji jest bardzo szeroka: od molekularnej, kiedy pod uwagę bierzemy spójnie zachowujące się zespoły drobin chemicznych, do wręcz kosmicznej, ponieważ to właśnie temu fenomenowi zawdzięczamy najwyraźniej np. kształt i rozmieszczenie galaktyk. Dziś coraz częściej zauważamy i analizujemy ich znaczenie. Wiele tego typu procesów możemy powtarzać w kontrolowanych warunkach swoich pracowni.
Interesującym przejawem samoorganizacji jest istnienie chemicznych reakcji oscylacyjnych. Mianem tym określa się grupę reakcji chemicznych, w których niektóre zależności koncentracjiproduktów i substratów od czasu nie mogą zostać opisane funkcją monotoniczną (rosnącą lub malejącą), lecz ich przebieg ma charakter oscylacji, powstających np. wskutek przełączania się układu między dwoma stanami stacjonarnymi.
Dziś znamy już stosunkowo wiele przykładów chemicznych procesów oscylacyjnych – ich liczba jest jednak oczywiście przytłaczająco mniejsza od reakcji zachowujących się w sposób klasyczny. W przeszłości pisałem już o chemiluminescencyjnej reakcji oscylacyjnej, w której roztwór reakcyjny emituje błyski światła w określonych odstępach czasu [1] [2]. Innymi przykładami reakcji oscylacyjnych tego typu są przykładowo reakcje Biełousowa-Żabotyńskiego (B-Ż) i Briggsa-Rauschera (B-R) [3] [4].
W warunkach amatorskich zaprezentowanie reakcji oscylacyjnych w rodzaju reakcji B-Ż i B-R napotyka często na wiele problemów, ponieważ wymagają one – poza posiadaniem odpowiednich substancji chemicznych - sporej dokładności w doborze i ważeniu odczynników. Reakcje te potrafią być kapryśne; czasem udają się, innym razem nie. Dlatego tym razem chciałbym opisać sposób, w jaki można przeprowadzić dwie uproszczone pod względem przygotowania, ale w dalszym ciągu interesujące reakcje oscylacyjne. Dodatkowo, obie zapewniają wspaniały efekt wizualny, co może pomóc w dydaktyce – szczególnie w zakresie kinetyki chemicznej, uważanej często przez uczniów i studentów za dziedzinę dosyć trudną i (bardzo niesłusznie, ale w to w dużej mierze „zasługa” niektórych prowadzących zajęcia) mało ciekawą.
W doświadczeniach wykorzystamy m.in. dwa kwasy organiczne i sole dwóch metali. W każdym przypadku efektem będzie ciecz okresowo zmieniająca barw.
Reakcja I
- kwas siarkowy(VI) H2SO4 stężony,
- bromian potasu KBrO3,
- kwas malonowy C3H4O4,
- siarczan manganu(II) jednowodny MnSO4·H2O.
Warto pamiętać, że kwas siarkowy(VI) ma właściwości żrące, a proces jego rozpuszczania w wodzie jest silnie egzotermiczny. Bromian potasu, siarczan manganu(II) i siarczan(VI) ceru(IV) są toksyczne, a kwas malonowy ma działanie drażniące na nasze tkanki, w tym skórę. Trzeba zachować ostrożność i stosować środki ochrony osobistej, jak zawsze przy pracy z chemikaliami.
Kwas malonowy - lub inaczej propanodiowy - jest organicznym związkiem z grupy kwasów dikarboksylowych (Rys.1). Nazwa tej substancji pochodzi od łacińskiego słowa malum oznaczającego jabłko i nie należy jej mylić z kwasem maleinowym czyli cis-butenodiowym C4H4O4. Kwas malonowy jest substancją silnie drażniącą i jego kontakt ze skórą lub błonami śluzowymi może się skończyć dosyć nieprzyjemnie.
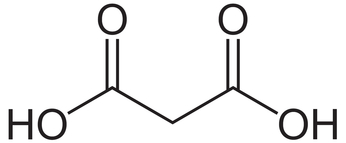
W warunkach normalnych kwas ten występuje w postaci białego ciała krystalicznego. Jako ciekawostkę można wspomnieć fakt, że odwadniając kwas malonowy jesteśmy w stanie uzyskać dosyć egzotyczne indywiduum chemiczne, jakim jest podtlenek węgla C3O2 [5].
Ważne: obecność jonów chlorkowych w układzie reakcyjnym może uniemożliwić zajście zarówno reakcji I, jak i II. Należy wykorzystywać wodę destylowaną, dobrze wymyte szkło i odczynniki o stosownej klasie czystości.
Najpierw musimy sporządzić odpowiednie roztwory. Ich bazą jest kwas siarkowy(VI) o stężeniu około 15%. Można go przygotować np. przez dodanie 75cm3 stężonego (96%, d=1,8g/cm3) kwasu siarkowego do 750cm3 wody destylowanej. Oczywiście pamiętajmy, by dodawać kwas do wody, a następnie ochłodzić mieszaninę. Roztwór kwasu przyda się także do przygotowania reakcji II.
Roztwory przygotowujemy według przepisu:
- A: 60cm3 roztworu kwasu siarkowego(VI) + 870mg kwasu malonowego + 760mg bromianu potasu,
- B: 20cm3 roztworu kwasu siarkowego(VI) + 170mg siarczanu manganu(II) [6, zmodyfikowano].
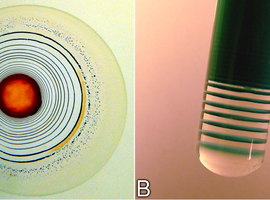
Przygotowane ciecze są bezbarwne (Fot.2).
Roztwory musimy połączyć w naczyniu odpowiedniej wielkości. Warunkiem efektywnego zajścia reakcji jest ciągłe mieszanie - najwygodniej posłużyć się w tym celu mieszadłem magnetycznym. Doświadczenie z racji wywiązywania się pewnych ilości pierwiastkowego bromu powinno być prowadzona pod wyciągiem.
Po zmieszaniu nowo powstały roztwór szybko przybiera pomarańczową barwę (Fot.3).
Wspomniana barwa po chwili zanika – wtedy rozpoczynają się oscylacje między bezbarwną a pomarańczową barwą roztworu, która jest jednak najczęściej nieco jaśniejsza niż w czasie indukcji reakcji (Fot.4).

Okres drgań w zależności od dokładności przy ważeniu odczynników i temperatury, w jakiej prowadzi się doświadczenie, może wynosić od kilku do kilkudziesięciu sekund. Oscylacje trwają zwykle od kilkunastu do kilkudziesięciu minut.
Reakcja II
Tym razem będziemy potrzebować substancji takich jak:
- kwas siarkowy(VI) stężony,
- bromian potasu,
- kwas cytrynowy jednowodny C6H8O7·H2O,
- siarczan(VI) ceru(IV) czterowodny Ce(SO4)2·4H2O
Uważne oko eksperymentatora od razu wychwyci, że wykorzystamy tutaj sól metalu stosunkowo rzadko goszczącego na naszym stole laboratoryjnym, to jest ceru Ce.
Siarczan(VI) ceru(IV) występuje w postaci bezwodnej, jak i w postaci różnorodnych hydratów - stopień jego uwodnienia może przyjmować wartości 4, 8 lub 12. W naszym przypadku wykorzystujemy tetrahydrat, który w warunkach normalnych jest ciemnożółtym ciałem krystalicznym (Fot.5).
Rozpuszczalność tej substancji w wodzie jest umiarkowana, na domiar złego w neutralnym roztworze wodnym związek rozkłada się, przechodząc w jasnożółty tlenek CeO2. Kwasowe, bardziej stabilne roztwory siarczanu ceru mają intensywnie żółty kolor [7]. Tetrahydrat traci wodę po podgrzaniu do 180-200°C. Siarczan ten jest silnym utleniaczem.
W tym doświadczeniu, zamiast wykorzystywanego uprzednio kwasu malonowego użyjemy łatwiejszego do zdobycia kwasu cytrynowego.
Kwas cytrynowy jest organicznym związkiem chemicznym z grupy hydroksykwasów polikarboksylowych i zawiera aż 3 grupy karboksylowe (Rys.2).
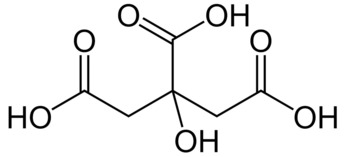
Kwas ten występuje w niewielkich ilościach we wszystkich organizmach żywych, ponieważ spełnia ważną rolę w metabolizmie węglowodanów. Jon cytrynianowy jest jednym z produktów przejściowych w cyklu Krebsa, który zresztą bierze od niego swoją drugą nazwę: cykl kwasu cytrynowego [8]. W większych ilościach występuje w niektórych owocach, np. w cytrynach. Może stanowić tam nawet do 8% suchej masy, co odpowiada 0,65% masy świeżej cytryny [9].
Przystępując do wykonania doświadczenia musimy ponownie sporządzić potrzebne roztwory. Rozcieńczony roztwór kwasu siarkowego możemy przygotować tak samo jak poprzednio.
- A: 30cm3 roztworu kwasu siarkowego(VI) + 753mg bromianu potasu,
- B: 30cm3 roztworu kwasu siarkowego(VI) + 9,46 g monohydratu kwasu cytrynowego,
- C: 10cm3 roztworu kwasu siarkowego(VI) + 0,81 g tetrahydratu siarczanu ceru(IV) [10].
Aby zapoczątkować reakcję do nowego naczynia trzeba przenieść całą objętość roztworów A i B, oraz 0,85cm3 roztworu C. Tutaj także konieczne jest dosyć intensywne mieszanie układu reakcyjnego.
Początkowo roztwór przybiera intensywnie żółtą barwę (Fot.6).
Po kilku minutach roztwór się odbarwia (Fot.7).
Od tego momentu rozpoczynają się oscylacje między roztworem bezbarwnym (w niektórych przypadkach delikatnie żółtawym) a intensywnie żółtym – prawie natychmiast pojawia się także narastające zmętnienie (powstaje trudno rozpuszczalny kwas monobromocytrynowy). Okres drgań układu wynosi od kilkudziesięciu sekund do kilku minut.

Wyjaśnienie
Podtytuł niniejszego artykułu jest nieco przekorny, ponieważ o ile prezentowane reakcje chemiczne są nieskomplikowane w przygotowaniu, to wyjaśnienie ich dokładnego mechanizmu nie jest już takie proste, a na pewno wykracza w pewnych aspektach znacznie poza zakres wiedzy ucznia, czy nawet studenta chemii. Dlatego, jeśli chodzi o mechanizmy przedstawionych procesów, ograniczę się tutaj jedynie do ich ogólnych założeń. Zależy mi natomiast, żeby pokazać Szanownemu Czytelnikowi, dlaczego moim zdaniem w reakcjach tych kryje się znaczny potencjał nie tylko dydaktycznym, ale także poznawczy.
W uproszczeniu reakcja I jest inicjowana przez redukcję anionu bromianowego kwasem malonowym z udziałem kationów manganu(II) jako katalizatora [11]:
w wyniku czego powstają czerwone akwajony manganu(III) nadające roztworowi pomarańczową barwę z powodu ich niewielkiego stężenia (możliwy jest w tym także pewien udział powstającego przejściowo bromu o czerwonej barwieprzy niskiej koncentracji).
Powstający kwas bromowy(I), HOBr, reaguje z kwasem malonowym, tworząc kwas monobromomalonowy:
który jest z kolei utleniany przez jony Mn3+, zgodnie z równaniem reakcji:
czemu towarzyszy odbarwienie roztworu, związane z niewielką intensywnością różowej barwy Mn2+(aq).
Charakterystyczny zapach bromu jest wyraźnie wyczuwalny w czasie reakcji i z racji toksyczności tego pierwiastka konieczne jest stosowanie wydajnego wyciągu. Przedstawiony powyżej mechanizm jest bardzo uproszczony - w układzie reakcyjnym zachodzi wiele powiązanych ze sobą specyficznych reakcji, czego efektem są widoczne oscylacje.
Mechanizm procesu zachodzącego w przypadku reakcji II jest zasadniczo podobny, z tą różnicą, że głównym czynnikiem odpowiedzialnym tutaj za zmianę barwy są przekształcenia między jonem ceru(IV) Ce4+ a ceru(III) Ce3+, ponieważ pierwsze wykazują w roztworze wodnym barwę żółtą, drugie zaś są bezbarwne.
W obu przypadkach jony metali mają działanie katalityczne. Po dokładniejszy opis warunków koniecznych do zajścia tego typu reakcji oscylacyjnych reakcji chemicznych zapraszam do odpowiedniej literatury [12] [13].
Zataczając niejako koło, chciałbym wrócić teraz do fenomenu samoorganizacji, na którego trop weszliśmy prowadząc opisane doświadczenia. Przykładem jednych z pierwszych odkrytych reakcji oscylacyjnych jest powstawanie pierścieni czy też pasm, które zostały opisane przez Rungego, a następnie zbadane na początku XX wieku przez Lieseganga. Struktury te cechują się geometryczną regularnością i powstają w czasie specyficznych reakcji zachodzących w żelu. Mogą formować się np. z osadu chromianu(VI) srebra Ag2CrO4 (Fot. 8A) lub zasadowych soli kobaltu (Fot. 8B) [14] [15].
Struktury Lieseganga wspominam nie tylko z powodu ich historycznego pierwszeństwa, ale także dlatego, że w naturze możemy spotkać podobne do nich obiekty pochodzenia organicznego.
Spacerując pod jabłonią lub innym drzewem, warto czasem spojrzeć na te owoce, które spadły i zaczynają ulegać rozkładowi. Fot.9 przedstawia jeden z nich.
Z łatwością możemy zauważyć, że skupienia grzybów lub innych mikroorganizmów układają się często na skórce rozkładających się owoców w charakterystyczne pasma lub pierścienie. W naturze możemy spotkać się także ze zjawiskiem tzw. czarcich lub czarodziejskich kręgów, formowanych przez owocniki grzybów (Fot.10). Nazwa, w większości języków nawiązująca do działalności sił nadprzyrodzonych, jest oczywiście związana z faktem, że przez tysiąclecia ludzie nierozumiejący mechanizmu powstawania kręgów przypisywali ich powstawanie czarom lub różnego rodzaju złym mocy.
Interesujące jest to, że wzięcie pod uwagę istnienia zjawiska samoorganizacji pozwala nam połączyć opisane zjawiska, jeśli chodzi o istotę mechanizmu stojącego za ich powstaniem. Zarówno struktury Lieseganga, jak i pierścieniowe ułożenie kolonii mikroorganizmów na rozkładających się owocach i owocników grzybów w czarcich kręgach można wytłumaczyć faktem istnienia zaskakująco podobnych zjawisk.
Dzięki prowadzeniu reakcji otrzymywania pierścieni Lieseganga w żelu, podczas procesu praktycznie nie występuje konwekcja, która w środowisku ciekłym mogłaby zaburzać lub w ogóle uniemożliwić powstanie wspomnianych struktur. Wydaje się, że formowanie pierścieni zachodzi na skutek złożenia dwóch procesów: dyfuzji odczynnika strącającego w głąb żelu, oraz spadku stężenia drugiego reagenta w sąsiedztwie obszarów intensywnego zachodzenia reakcji strącania materiału formującego pierścienie. W bezpośrednio przylegających do strefy reakcji obszarach żelu stężenie jonów drugiego reagenta maleje z racji ich pasmo osadu powstaje dopiero, gdy czynnik strącający dotrze do kolejnej strefy o odpowiednim do zajścia reakcji stężeniu obu reagentów.Istotną rolę pełnią tu także procesy powstawania i wzrostu ośrodków krystalizacji.
Jeśli chodzi o grzyby, to podczas swojego rozwoju mogą one silnie wyjaławiać podłoże, lub nawet zatruwać je swoimi metabolitami. W ten sposób inne organizmy nie mogą na nim żyć – możliwe staje się to dopiero w pewnej odległości. Tak więc grzybnia rozrastająca się koliście w glebie z pojedynczego zarodnika formuje krąg lub nawet serię koncentrycznych kręgów, natomiast na owocach wyraźne pasma. Myślę, że Czytelnik zauważy tu interesujące analogie, które mogą stać się wstępem do dalszych rozważań.
Literatura:
- [1] Ples M., Pulsujące światło - chemiluminescencyjne oscylacje, Chemia w Szkole, 3 (2019), Agencja AS Józef Szewczyk, str. 44-48 powrót
- [2] Pękala K., Jurczakowski R., Lewera A., Orlik M., Luminescent Chemical Waves in the Cu(II)-Catalyzed Oscillatory Oxidation of SCN-Ions with Hydrogen Peroxide, The Journal of Physical Chemistry A, 111(18), 2007, str 3439–3442 powrót
- [3] Żabotyński A. M., Периодический процесс окисления малоновой кислоты растворе - исследование кинетики реакции Белоусова (pol. Procesy periodyczne utleniania kwasu malonowego w fazie ciekłej - badanie kinetyki Biełousowa, Биофизика (pol. Biofizyka), 9, 1964, str. 306-311 powrót
- [4] Briggs T. S., Rauscher W. C., An Oscillating Iodine Clock, Journal of Chemical Education, 50 (7), 1793, str. 496 powrót
- [5] Gajewski W. (red.), Encyklopedia techniki – Chemia, Wydawnictwa Naukowo-Techniczne, Warszawa, 1965, str. 548 powrót
- [6] Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, 2001, str. 219-220 powrót
- [7] Lide D. R., CRC Handbook of Chemistry and Physics (87th ed.), CRC Press, 2006 powrót
- [8] Berg J.M., Tymoczko J.L., Stryer L., Clarke N.D., Szweykowska-Kulińska Z., Jarmołowski A., Augustyniak H., Biochemia, Wydawnictwo Naukowe PWN, Warszawa, 2007 powrót
- [9] Hassa R., Mrzigod J., Podręczny słownik chemiczny, Videograf II, Katowice, 2004 powrót
- [10] Seidl M., Oszillierende Reaktion mit Citronensäure, w serwisie: https://www.chem-page.de, dostępne online: https://www.chem-page.de/experimente/oszillierende-reaktion-mit-citronensaeure.html [dostęp: 09.11.2020] powrót
- [11] There and back again on the way to equilibrium: The Belousov-Zhabotinsky reaction, w serwisie: http://people.bu.edu, dostępne online: http://people.bu.edu/straub/courses/demomaster/belousov.html [dostęp: 09.11.2020] powrót
- [12] Orlik M., Reakcje oscylacyjne – porządek i chaos, Wydawnictwa Naukowo-Techniczne, Warszawa, 1996 powrót
- [13] Bray W. C., A periodic reaction in homogeneous solution and its relation to catalysis, Journal of the American Chemical Society, 43 (6), 1921, str. 1262 powrót
- [14] Ples M., Porządek z chaosu. O samoorganizacji i pierścieniach Lieseganga, Chemia w Szkole, 1 (2016), Agencja AS Józef Szewczyk, str. 15-19 powrót
- [15] Ples M., Pierścienie Lieseganga, w serwisie: http://weirdscience.eu, dostępne online: http://weirdscience.eu/Pier%C5%9Bcienie%20Lieseganga.html [dostęp: 09.11.2020] powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples