Śledztwo - prosta metoda wykrywania obecności krwi
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (5/2018):

Kryminalistykę definiuje się najczęściej jako swoistą naukę o zasadach i sposobach rozpoznawania (wykrywania) pewnych zjawisk społecznych o negatywnym charakterze, a w szczególności przestępstw i ich sprawców. W kręgu zainteresowań kryminalistyki znajdują się też oczywiście techniczne metody i środki pozwalające na potwierdzenie istnienia związku - lub jego braku - między osobami a zdarzeniami [1].
Za początki współczesnej kryminalistyki należy uznać działania sięgające XIX wieku. Dziedzina ta z założenia od swego zarania była ściśle powiązana z innymi gałęziami wiedzy, między innymi z kryminologią i medycyną - co spowodowało także wyodrębnienie się działu nauk nazywanego dziś medycyną sądową. Wielkie zasługi rozwojowi kryminalistyki oddał Alphonse Bertillon - francuski funkcjonariusz policji, a zarazem uczony. Wprowadził do działań śledczych metodologię naukową i jest dziś znany głównie jako twórca obiektywnych metod identyfikacji człowieka, takich jak antropometria, portret pamięciowy i fotografia śledcza. Duże znaczenie dla kryminalistyki miał też wynalazek Francisa Galtona, jakim była daktyloskopia.
Dowodem zbrodni mogą być ślady krwi pozostałe na miejscu przestępstwa, na jej narzędziach, a także na ubraniu sprawcy. Ślady te mogą być zestarzałe i nikłe, trudne nie tylko do odróżnienia od innych zanieczyszczeń, ale także do samego zauważenia gołym okiem. Dlatego techniki kryminalistyczne oferują wiele metod wykrywania obecności nawet minimalnych ilości krwi. Jedną z nich jest wykorzystanie odczynnika Kastle-Meyera (K-M), którego otrzymanie oraz zastosowanie w kierunku wykrywania krwi zostało opisane na początku XX wieku [2] [3]. Przygotowanie odczynnika i przeprowadzenie odpowiednich doświadczeń nie powinno nastręczać trudności w pracowni chemicznej lub biologicznej.
Przygotowanie odczynnika
Aby przygotować odczynnik Kastle-Meyera potrzebujemy następujących substancji:
- fenoloftaleina C20H14O4,
- cynk Zn (proszek),
- wodorotlenek sodu NaOH,
- alkohol etylowy 70% C2H5OH.
W kontakcie z wymienionymi substancjami trzeba zachować ostrożność jak zawsze przy pracy z chemikaliami. Należy unikać wdychania pyłów fenoloftaleiny, ponieważ podejrzewa się ją o właściwości rakotwórcze. Drobny pył cynkowy może być łatwopalny, podobnie jak alkohol etylowy. Stężone roztwory wodorotlenku sodu są silnie żrące, dlatego konieczne są odpowiednie środki ochrony osobistej.
Fenoloftaleina słabo rozpuszcza się w wodzie, za to dosyć dobrze w alkoholach. W stanie czystym występuje w postaci białej substancji krystalicznej (Fot.1).
W laboratoriach fenoloftaleina spotykana jest głównie jako ok. 1% roztwór w etanolu. Jest wykorzystywana jako wskaźnik kwasowo-zasadowy, ponieważ w środowisku kwasowym lub obojętnym jej roztwory są bezbarwne (Fot.2A), zaś w zasadowym różowofioletowe (Fot.2B).
Istnieje wiele metod przygotowania odczynnika K-M, ja jednak podam sposób wypróbowany przeze mnie [4].
Pierwszą czynnością jest przygotowanie 50cm3 roztworu wodorotlenku sodu o stężeniu 25%. Należy mieć na uwadze, że rozpuszczanie tej substancji jest silnie egzotermicznym procesem, ciecz rozgrzewa się więc samorzutnie do wysokiej temperatury. W tak przygotowanym roztworze należy rozprowadzić 0,5g stałej fenoloftaleiny. Uzyskany silnie zasadowy roztwór powinien być jasnofioletowy, jak to widać na Fot.3.
Kolejną potrzebną substancją jest sproszkowany cynk. O ile w postaci litej pierwiastek ten ma postać srebrzystego metalu, to jako drobnoziarnisty proszek jest ciemnoszary (Fot.4).
Do uprzednio przygotowanego roztworu wodorotlenku sodu i fenoloftaleiny należy w dalszej kolejności dodać 0,5g proszku cynkowego i dobrze wymieszać, co powinno wyglądać mniej więcej jak na Fot.5.
Jeśli nasza mieszanina reakcyjna jest gotowa to możemy zacząć ją ogrzewać aż do delikatnego wrzenia. Przydatna jest tutaj chłodnica zwrotna, ale przy jej braku można po prostu w czasie wrzenia uzupełniać ubytki wody, tak by zachować początkową objętość.
Po pewnym czasie – zwykle wystarcza kilka, kilkanaście minut – roztwór ulega odbarwieniu, tzn. staje się bezbarwny lub delikatnie żółtawy. Przerywamy wtedy ogrzewanie i pozwalamy, żeby nieprzereagowany cynk i stałe produkty uległy sedymentacji (Fot.6).
Bezbarwny roztwór trzeba po ostygnięciu odsączyć i przenieść do szczelnie zamykanej butelki z brązowego szkła. Na jej dnie dobrze jest umieścić niewielką ilość świeżego proszku cynkowego. Przechowywany bez dostępu światła i w niezbyt wysokiej temperaturze roztwór podstawowy jest stosunkowo trwały.
Roztwór roboczy przygotowuje się na bieżąco z roztworu podstawowego (który należy pobierać znad warstwy cynku) poprzez jego dziesięciokrotne rozcieńczenie 70% alkoholem etylowym. W ten sposób odczynnik Kastle-Meyera jest gotowy.
Roztwór roboczy należy wykorzystać dosyć szybko do analiz, ponieważ w przeciwieństwie do roztworu podstawowego jest nietrwały.
Analiza
Chciałbym tutaj przestrzec przed wykorzystywaniem w doświadczeniach krwi czy innego materiału biologicznego nieznanego pochodzenia, ponieważ mogą być one źródłem niebezpiecznych patogenów. W zastępstwie krwi można wykorzystywać np. izolowaną hemoglobinę. Jeśli chodzi o prezentowane tutaj doświadczenia, to wykorzystałem w nich własną krew.
Próbę Kastle-Meyera można przeprowadzić w odniesieniu do materiału, który podejrzewamy o wcześniejszy kontakt z krwią. Opisywana metoda jest bardzo czuła (przynajmniej jak na metodę czysto chemiczną). Aby się o tym przekonać wystarczy przeprowadzić odpowiedni test.
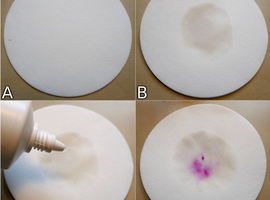
Krążek bibuły filtracyjnej został potarty plastrem z zestarzałą plamą krwi (Fot.8A). Gołym okiem nie można dostrzec na nim nawet śladu zabrudzenia – papier wydaje się być całkowicie czysty. Chcąc przeprowadzić próbę należy go zwilżyć odczynnikiem Kastle-Meyera (Fot.8B), a następnie kilkoma kroplami 3% roztworu nadtlenku wodoru H2O2, czyli aptecznej wody utlenionej (Fot.8C). Szybkie – w ciągu kilku, maksymalnie kilkunastu sekund – wystąpienie śladów charakterystycznej dla fenoloftaleiny barwy świadczy o prawdopodobnym kontakcie badanego materiału z krwią (Fot.8D). Jeśli barwa nie występuje, lub pojawia się po dłuższym czasie, to wynik próby uznaje się za negatywny.
Opisywany sposób można stosować np. w odniesieniu do tkanin, papieru i podobnych materiałów. Co jednak zrobić, jeśli chcemy sprawdzić obecność krwi na innych przedmiotach, np. na młotku (Fot.9)? Jeśli podejrzewa się go o bycie narzędziem zbrodni, to stwierdzenie tego faktu może mieć kluczowe znaczenie.
W takim przypadku wygodnie jest się posłużyć wacikiem lub bibułowym sączkiem złożonym na czworo (Fot.10A). Przedmiot podejrzewany o kontakt z materiałem biologicznym następnie pociera się ostrym wierzchołkiem złożonej bibuły, dzięki czemu przenoszą się na nią drobiny ewentualnych zabrudzeń krwią (Fot.10B).
Po rozprostowaniu bibuły (Fot.11A) postępujemy jak poprzednio, tj. nasączając ją odczynnikiem Kastle-Meyera, a następnie wodą utlenioną. Szybkie wystąpienie barwy różowej świadczy o możliwym kontakcie analizowanego przedmiotu z krwią (fot.11B).
Gwoli wyjaśnienia nadmienię jeszcze, że wdrożone dochodzenie wykazało, iż obecność krwi na analizowanym narzędziu nie była wynikiem żadnej zbrodni, a tylko niewielkiego urazu, co zdarza się w każdym warsztacie mimo stosowania zasad BPH.
Wyjaśnienie
Jak wiemy, fenoloftaleina w środowisku zasadowym przybiera barwę różowofioletową. Jej zanik w wyniku ogrzewania wraz z cynkiem jest wynikiem redukcji fenoloftaleiny C20H14O4 (Rys.1A) do fenoloftaliny C20H16O4 (Rys.1B).
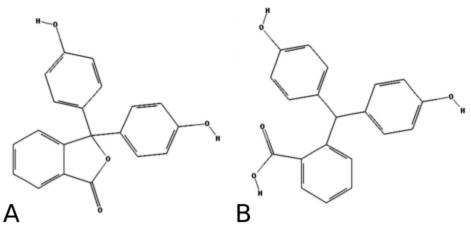
W odróżnieniu od fenoloftaleiny jej zredukowana forma nie odznacza się żadną wyraźną barwą w środowisku zasadowym, co objawia się odbarwieniem roztworu.
Fenoloftalina może jednak zostać ponownie utleniona do barwnej fenoloftaleiny (w środowisku zasadowym) przez utleniacze takie jak nadtlenek wodoru. Proces ten zwykle przebiega dosyć wolno – przyspieszają go jednak wyraźnie pewne katalizatory. Jednym z nich jest zawarty w czerwonych krwinkach barwnik oddechowy, czyli hemoglobina. Dzięki temu w kontakcie z krwią zostaje przywrócona różowa barwa.
Podobne metody
Istnieją także inne metody wykrywania krwi oparte na podobnej zasadzie. Jedną z nich jest wykorzystanie zredukowanej formy fluoresceiny C20H12O5, nazywanej fluorescyną C20H14O5 [Fot.12]. Pierwsza ze wspomnianych substancji wykazuje bardzo silną fluorescencję w świetle UV, natomiast druga nie.
W tym przypadku oznaką występowania krwi nie jest zmiana barwy. Próbka krwi (Fot.13A) w kontakcie z fluorescyną i utleniaczem zostaje uwidoczniona dzięki jaskrawozielonej fluorescencji (Fot.13B), ponieważ w kontakcie z hemoglobiną zostaje odtworzona fluoresceina [5].
Istnieją także metody wykorzystujące chemiluminescencję luminolu C8H7N3O2 [6]. Luminol w normalnych warunkach ma postać proszku o barwie żółtawej i jest bardzo wydajnym chemiluminoforem. Do przyrządzenia 300cm3 roztworu roboczego wystarczyła ilość substancji widoczna na Fot.14.
Roztwór luminolu jest bezbarwny (Fot.15). Dla większych stężeń lub w razie zanieczyszczenia chemiluminoforu ciecz może mieć żółtawe zabarwienie.
Luminol utleniany nadtlenkiem wodoru w roztworze wodnym (środowisko zasadowe) emituje niebieskie światło, ale wymaga do tego katalizatora – podobnie jak w poprzednich przypadkach może być nim hemoglobina. Fot.16 przedstawia chemiluminescencję po dodaniu do wspomnianego poprzednio roztworu suszonego izolatu hemoglobiny bydlęcej.
Zarówno metoda wykorzystująca fluorescynę, jak i oparta o właściwości luminolu pozwala na dosyć wygodne stwierdzenie obecności krwi na miejscu zbrodni, nawet mimo prób zatarcia śladów. Przydatne jest tu także wykorzystanie fotografii o długim czasie ekspozycji, ponieważ umożliwia to rejestrację nawet słabych sygnałów świetlnych.
Ograniczenia
Trzeba wspomnieć o bardzo poważnej wadzie metody wykrywania krwi z wykorzystaniem odczynnika Kastle-Meyera. Okazuje się bowiem, że nie tylko hemoglobina katalizuje reakcję utleniania fenoloftaliny – takie samo działanie mogą mieć niektóre enzymy roślinne i wiele innych substancji chemicznych. Metoda ta pozwala więc raczej na wykluczenie obecności krwi (w razie wyniku negatywnego), niż jej jednoznaczne potwierdzenie w przypadku wyniku pozytywnego, ponieważ może być on spowodowany innymi czynnikami niż tylko obecnością krwi. Wadę tę posiadają zresztą także pozostałe metody oparte na katalitycznym utlenianiu. Można to rozwiązać poprzez odpowiednie wygrzewanie próbki, co powoduje unieczynnienie enzymów roślinnych, nie ma natomiast wpływu na hemoglobinę. Mając na uwadze wspomniane ograniczenia możemy jednak wykorzystywać odczynnik Kastle-Meyera w celu wstępnego stwierdzania obecności krwi.
Literatura:
- [1] Hanausek T., Kryminalistyka – zarys wykładu, Zakamycze, 2005, str. 23 powrót
- [2] Kastle J. H., Shedd O. M., Phenolphthalin as a reagent for the oxidizing ferments, American Chemical Journal, 1901, 26 (6), str. 526 - 539 powrót
- [3] Meyer E., Beiträge zur Leukocytenfrage. Fermente der Leukocyten, Münchener Medizinische Wochenschrift, 1903, 50 (35), str. 1489 - 1493 powrót
- [4] Helmenstine A. M., How To Make Kastle-Meyer Solution, w serwisie: https://www.thoughtco.com/, dostępne online: https://www.thoughtco.com/how-to-make-kastle-meyer-solution-608141 [dostęp: 19.08.2018] powrót
- [5] Ples M., Na tropie - fluorescencyjne wykrywanie śladów krwi, Chemia w Szkole, 1 (2015), Agencja AS Józef Szewczyk, str. 25-26 powrót
- [6] Ples M., Chemik na tropie - chemiluminescencja aktywowana krwią, w serwisie: https://weirdscience.eu, dostępne online: http://weirdscience.eu/Chemik%20na%20tropie%20-%20chemiluminescencja%20aktywowana%20krwi%C4%85.html [dostęp: 19.08.2018] powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples