Jak wyhodować węża?
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (4/2018):

Trochę wyobraźni
Wyobraźnią nazywamy zwykle zdolność do tworzenia pomysłów oraz wrażeń (obrazów, dźwięków i innych) bez konieczności bezpośredniego wykorzystania informacji dostarczanych przez zmysły. Dzięki wyobraźni możemy więc przeżywać to, czego fizycznie w danym momencie nie doświadczamy. Pozwala też nam ona obrazować sobie - lub widzieć oczami umysłu (łac. mentis oculi, według Cycerona) - to, co jeszcze nie istnieje, ale co być może uda się urzeczywistnić. Tutaj tkwi wartość wyobraźni dla naukowca, wynalazcy czy pedagoda, ponieważ to właśnie dzięki niej możemy twórczo wykorzystywać zgromadzoną wcześniej wiedzę. W tym aspekcie rację miał więc Albert Einstein mówiąc, że "wyobraźnia jest ważniejsza niż wiedza, bo choć wiedza wskazuje na to, co jest, wyobraźnia wskazuje na to, co będzie" [1].
Wyobraźnię, jak każdą inną zdolność, można trenować. Już dziecięcy umysł - nieskrępowany jeszcze schematami myślowymi - karmi się często baśniami czy innymi utworami fantastycznymi. Może to być początek bardziej dojrzałej formy wyobraźni, np. tej pomagającej w stawianiu pytań na temat praw rządzących otaczającym nas światem, a także w poszukiwaniu metod pozwalających na znalezienie odpowiedzi na te pytania.
Wśród bardzo wielu różnego rodzaju opowieści fantastycznych, duże znaczenie ma dla mnie twórczość niemieckiego pisarza Michaela Ende. Mimo upływu lat od pierwszego spotkania z książkami tego autora pamiętam, , jakie wrażenie na mnie zrobiła niesamowita wyobraźnia, jakiej musiało wymagać stworzenie zawartych w nich historii. Szczególnie chętnie wracam do „Niekończącej się historii” (niem. Die Unendliche Geschichte, 1979 r.), w której za każdym razem znajduję nowe tematy do przemyśleń.
Zauważmy, że także od nas (jako eksperymentatorów) sytuacja często wymaga wyobraźni. To właśnie ona pozwala nam porównywać pewne twory powstałe w naszym laboratorium do otaczających nas obiektów, np. roślin i żywych organizmów [2] [3]. Zauważmy jednak, że zainteresowanie rozbudzone dzięki wyobraźni zawsze powinno być wykorzystane do powiększenia naszego stanu wiedzy.
Tym razem, niejako nawiązując do wspomnianej już uprzednio "Nie kończącej się historii" - wielką rolę grał w niej Auryn, będący symbolem przedstawiającym dwa splecione węże - chciałbym zaproponować sposób hodowli w naszym laboratorium struktur przypominających rosnące i wijące się beznogie gady.

Powyższy wstęp może wydać się niektórym Czytelnikom nieco nietypowy. Pamiętajmy jednak, że ukazuje się on w wakacyjnym numerze Chemii w Szkole. Myślę, że w tym czasie możemy sobie - a może nawet powinniśmy - pozwolić na pewne odstępstwa od rygorów szkolnych. Ułatwia to wyjście poza utarte schematy myślenia, co bywa źródłem nowych pomysłów i z tego powodu powinno być jak najbardziej pożądane.
Doświadczenie
Struktury przywodzące na myśl wijące się węże lub różnego rodzaju bajkowe stwory każdy chemik może otrzymać na różne sposoby. Jednym z bardziej znanych jest wykorzystanie rodanku rtęci(II) Hg(SCN)2. Rzeczywiście, w wyniku termicznego rozkładu tej substancji powstają bardzo duże ilości puszystego popiołu formującego kształty, w których przy odpowiedniej dozie wyobraźni można dopatrzyć się węży [4]. Doświadczenie to jest znane jako węże Faraona – być może dzięki skojarzeniu z historią biblijną (Exodus, rozdział 7). Niestety rodanek rtęci(II) jest silnie toksyczny, podobnie jak większość związków tego metalu. Dodatkowo w czasie reakcji uwolnione zostają inne szkodliwe związki, a także wolna metaliczna rtęć, która w dużej mierze odparowuje. Dlatego trudno polecić to doświadczenie komukolwiek, a już szczególnie dydaktykom w ramach zajęć szkolnych lub uczelnianych. Moim zdaniem nie jest tutaj dobrym rozwiązaniem proponowane przez niektórych autorów wykonywanie tego doświadczeniea na zewnątrz. Każda ilość rtęci uwolniona do środowiska może mieć na nie bardzo niekorzystny wpływ. Usprawiedliwianie trucicielstwa samą jego niewielką skalą nie powinno być w żadnym razie tolerowane.
Inną wykorzystywaną w podobnym celu reakcją jest działanie stężonego kwasu siarkowego(VI) H2SO4 na cukier spożywczy czyli sacharozę C12H22O11. Doświadczenie to jest nieco bezpieczniejsze, ale trzeba pamiętać, że przy operowaniu stężonym kwasem należy z wiadomych powodów zachować daleko idącą ostrożność i korzystać ze środków ochrony osobistej.
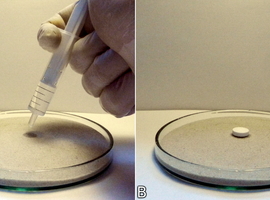
W celu przeprowadzenia doświadczenia należy do zlewki wsypać nieco zwykłego cukru spożywczego w postaci niezbyt dużych kryształów. Jego objętość powinna być trochę większa niż połowa naczynia (Fot. 1A).
Następnie na powierzchnię cukru należy ostrożnie wylać kilka centymetrów sześciennych stężonego kwasu siarkowego(VI), a potem szybko wymieszać wszystko szklaną bagietką. Można zauważyć, że prawie natychmiast cukier zaczyna wyraźnie ciemnieć (Fot.1B).
Delikatnie dotykając naczynia lub posługując się termometrem można zauważyć szybki wzrost temperatury w czasie zachodzącego procesu. Po niedługim czasie mieszanina nabiera czarnej barwy, zaczyna gwałtownie parować i powiększać swoją objętość unosząc się z naczynia (Fot.1C). Należy unikać wdychania powstających par, ponieważ silnie drażnią one układ oddechowy.
Po pewnym czasie powstaje wysoka, podłużna struktura (Fot.2). Czasem łamie się ona lub wygina pod własnym ciężarem. W każdym razie w pęczniejącej masy, wydzielającej opary o odrażającym zapachu nietrudno dopatrzyć się widoku jakiejś wężokształtnej maszkary.
Łatwo zauważyć, że powstający „wąż” ma gąbczastą strukturę. Można to wyjaśnić sposobem, w jaki powstaje – dochodzi tutaj do dehydratacji sacharozy będącej przecież węglowodanem. Cukier ulega wtedy zwęgleniu w myśl równania reakcji:
Powstająca woda zostaje związana przez higroskopijny kwas. Wąż zawdzięcza więc swą czarną barwę węglowi, który jest jego głównym składnikiem.
Opisane powyżej doświadczenie jest ciekawe, zapewnia interesujący efekt wizualny, ale jego wykonanie może być problematyczne z powodu wykorzystywania w nim stężonego kwasu siarkowego(VI) będącego dosyć niebezpieczną substancją.
Czy można bezpieczniej?
Dla chcącego nic trudnego – wystarczy jedynie znaleźć odpowiednią substancję chemiczną. Powinna ona być nietoksyczna, nie mieć właściwości żrących ani niszczących nasze tkanki w inny sposób. Warunkiem koniecznym jest też dużo większa objętość produktów stałych w porównaniu z substratami. Dodatkowym atutem byłoby, jeśli omawiana substancja byłaby łatwo dostępna i tania.
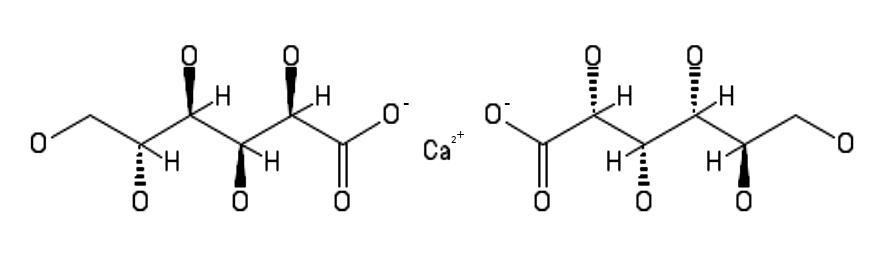
Wszystkie opisane warunki spełnia glukonian wapnia C12H22CaO14 (Rys.1).
Omawiany glukonian jest wykorzystywany w medycynie jako źródło wapnia przy jego niedoborach w organizmie [5]. Substancja ta jest w normalnych warunkach nietoksyczna, ale powinna być wykorzystywana jedynie w przypadku stwierdzonych braków wapnia w diecie. Stosowanie jej w zbyt dużych ilościach bez konsultacji z lekarzem może nieść ryzyko pewnych niekorzystnych skutków ubocznych. W każdym razie glukonian wapnia jest dostępny w aptekach.
W warunkach normalnych glukonian ma postać białego, krystalicznego proszku. W handlu najczęściej występuje w postaci tabletek widocznych na Fot.3.
Niestety glukonian nie spala się samodzielnie, tak jak rodanek rtęci(II). Jego rozkład wymaga więc dostarczenia energii na sposób ciepła. Można to rozwiązać przy zastosowaniu płytkiego naczynia, np. szalki Petriego czy choćby talerza wypełnionego suchym piaskiem. Pośrodku piasek należy nasączyć paroma centymetrami sześciennymi alkoholu etylowego C2H5OH, izopropylowego C3H7OH lub innego (Fot.4A). Nasączony obszar powinien mieć powierzchnię niewiele większą od umieszczonej na nim tabletki glukonianu wapnia (Fot.4B).
Całe naczynie trzeba umieścić na niepalnej i odpornej na podwyższoną temperaturę powierzchni, a następnie podpalić alkohol.
Ogień płonącego alkoholu jest słabo widoczny i nie daje w tych warunkach zbyt wiele światła. Dzięki temu z łatwością zauważamy, prawie natychmiast z przed chwilą jeszcze całkowicie białą tabletką zaczyna dziać się coś dziwnego: czernieje, jakby puchnie, a po chwili zaczyna wyłaniać się z niej ciemny, wijący się i rosnący w oczach twór (Fot.5). Przywodzi on na myśl bezokiego węża wychodzącego z wykopanej w piasku nory.
Wąż rośnie i porusza się tak długo, aż nie rozłoży się materiał całej tabletki, albo nie wyczerpie się paliwo w postaci alkoholu.
Doświadczenie można przeprowadzić też inaczej, rezygnując z naczynia i piasku. Potrzebne jest wtedy jednak inne źródło ciepła. Korzystne wydaje się wykorzystanie w tym celu pastylek suchego paliwa turystycznego. Dusza eksperymentatora wymaga jednak, żeby samemu przygotować odpowiednie paliwo. W tym przypadku proponuję wykonanie palnej… galaretki.
By ją przygotować potrzebujemy nieszkodliwej substancji jaką jest octan wapnia C4H6CaO4. Jest to krystaliczny proszek, dosyć łatwo rozpuszczający się w wodzie (Fot.6).
Octan wapnia jest wykorzystywany w przemyśle spożywczym jako konserwant, a także przy technicznej produkcji kwasu octowego [6].
Musimy sporządzić roztwór octanu poprzez rozpuszczenie kilku gramów tej substancji w jak najmniejszej ilości wody destylowanej – najlepiej na gorąco. Osobno przygotowujemy 20cm3 alkoholu etylowego lub izopropylowego o jak najwyższym stężeniu. Ja wykorzystałem po prostu spirytus spożywczy. Do alkoholu trzeba dodać odrobinę przesączonego, jeszcze ciepłego roztworu octanu wapnia (Fot.7A). Konieczne jest przy tym dosyć intensywne mieszanie. Prawie natychmiast powstaje galaretka, a raczej żel (Fot.7B).
Rozpuszczalność octanu wapnia w alkoholach jest dużo mniejsza niż w wodzie. Po dodaniu więc niewielkiej ilości wodnego roztworu do alkoholu, rozpuszczalność tego związku gwałtownie maleje. Wypadający z roztworu octan formuje gęstą sieć, w której zostają uwięzione cząsteczki alkoholu. Powstały w ten sposób żel jest naprawdę sztywny – zawierającą go zlewkę można bez obaw odwrócić do góry dnem (Fot.8). Oczywiście takiej galaretki nie należy spożywać.
Jako, że opisana galaretka w głównej mierze składa się z alkoholu, to odznacza się ona doskonałą palnością. Jeśli wykorzystane substancje były czyste chemicznie (także woda), to po umieszczeniu na niepalnej podstawie i podpaleniu żel spala się z ledwie widocznym, niebieskawym płomieniem (Fot.9A). Jest to sprzyjająca w doświadczeniu okoliczność, ale jeśli komuś by zależało na widoczności płomienia to wystarczy do galaretki wprowadzić niewielką ilość chlorku sodu NaCl, by płomień nabrał charakterystycznej i dobrze widocznej barwy żółtej (Fot.9B).
Po całkowitym wypaleniu się galaretki pozostaje bardzo niewiele substancji stałych.
Chcąc wykorzystać otrzymaną w przytoczony powyżej sposób galaretkę jako paliwo dla naszego węża najlepiej jest uformować ją w kształt niewielkich walców o średnicy podobnej do tabletek glukonianu. Może to ułatwić prosty przyrząd wykonany ze zwykłej strzykawki. Odpowiedni będzie egzemplarz o pojemności 5cm3. Przeróbka strzykawki nie jest trudna – wystarczy obciąć ostrym nożem jej koniec, tak by otrzymać prostą rurkę, w której może poruszać się tłok (Fot.10A). Do rurki należy następnie nałożyć pewną ilość żelu, a potem docisnąć tłoczkiem (Fot.10B). Tłoczek jest także pomocny w wypchnięciu gotowej pastylki paliwa z przyrządu (Fot.10C).
Przygotowaną w ten sposób pastylkę paliwa trzeba położyć w pozycji pionowej na niepalnej podstawie, a na niej umieścić tabletkę glukonianu jak to pokazano na Fot.11.
Po podpaleniu tak przygotowanego zestawu substancji możemy być ponownie świadkami powstania fantazyjnie powyginanego węża. Przedstawiona sekwencja zdjęć (Fot.12) obrazuje czego się możemy spodziewać.
Warto wspomnieć też o innej prostej modyfikacji tego doświadczenia. Aby uzyskać dodatkowy ciekawy efekt wystarczy tabletkę położyć nie płasko, ale na krawędzi bocznej, tak jak pokazano to na Fot.13.
Okazuje się, że nawet tak prosta zmiana warunków doświadczenia pozwala na otrzymanie struktury jeszcze bardziej przypominającej jakiegoś stwora, ponieważ w takim przypadku z tabletki wyłaniają się początkowo dwie czarne, wijące się niby-macki (Fot.14). Dopiero w ślad za nimi zaczyna rosnąć „ciało” węża.
Pozostałości po doświadczeniu nie są toksyczne, więc pozbycie się ich nie stanowi problemu.
Wyjaśnienie
Przyczyną obserwowanego zachowania glukonianu wapnia w opisanych warunkach jest jego utlenianie w podwyższonej temperaturze. Zachodzi ono według równania reakcji:
Węgiel C i tlenek wapnia CaO powstające tu jako produkty reakcji są ciałami stałymi i to one formują strukturę węża. Natomiast woda H2O i dwutlenek węgla CO2 są w warunkach reakcji gazami, więc opuszczają układ. Zanim to jednak zrobią, formują pęcherzyki w lepkiej masie reagentów. Dzięki temu struktura węża ma postać gąbki i odznacza się bardzo niewielką sumaryczną gęstością. Następuje wielokrotne zwiększenie objętości produktów w stosunku do substratów. Łatwo stwierdzić, że powstający materiał jest bardzo lekki – unosi się przy najlżejszych podmuchach powietrza.
Myślę, że to proste, a ciekawe doświadczenie może być źródłem przyjemności z poznawania tajników chemii.
Literatura:
- [1] Kronenberger M., Muzykoterapia. Podstawy teoretyczne do zastosowania muzykoterapii w profilaktyce stresu, Wydawnictwo Mediatour, Szczecin, 2003 powrót
- [2] Ples M., Chemiczne rośliny, Chemia w Szkole, 5 (2015), Agencja AS Józef Szewczyk, str. 6-9 powrót
- [3] Ples M., Metaliczne rośliny. Krystaliczne dendryty srebra, Chemia w Szkole, 3 (2015), Agencja AS Józef Szewczyk, str. 6-10 powrót
- [4] Sękowski S., Ciekawe doświadczenia. Część I, Państwowe Zakłady Wydawnictw Szkolnych, Warszawa, 1973, str. 152-156 powrót
- [5] British national formulary: BNF 69 (69 ed.), British Medical Association, 2015 powrót
- [6] Gajewski W., Encyklopedia techniki. Chemia, Wydawnictwa Naukowo-Techniczne, Warszawa, 1965 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Poniżej przedstawiam film przedstawiający przygotowanie doświadczenia, a także narodziny i wzrost "węża".
Marek Ples