Elektryczność z powietrza
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (5/2016):

Ogniwo glinowo-tlenowe
Czasy obecne z pewnością można nazwać wiekiem elektryczności. Technika stosowana przez naszą cywilizację opiera się przecież głównie na wykorzystaniu tej właśnie formy energii.
Czym jest prąd elektryczny? Definiuje się go jako uporządkowany ruch cząstek obdarzonych ładunkiem elektrycznym nazywanych nośnikami ładunku. Przepływ prądu w obwodzie jest możliwy dzięki istnieniu siły elektromotorycznej SEM generowanej przez różnego rodzaju źródła energii elektrycznej. W przypadku ogniw elektrochemicznych siła elektromotoryczna jest wynikiem reakcji chemicznych zachodzących w ogniwie. Po zamknięciu obwodu zewnętrznego wywołuje w nim różnicę potencjałów elektrycznych (napięcie elektryczne U), co pociąga za sobą ruch ładunków czyli przepływ prądu elektrycznego.
Źródła prądu elektrycznego muszą wytwarzać różnicę potencjału kosztem innych form energii. Ich rodzajem wykorzystującym energię chemiczną są ogniwa galwaniczne, których rodowód sięga końca XVIII wieku i prac Luigi Galvaniego, który stwierdził, że wypreparowane mięśnie żaby kurczą się w kontakcie z metalowymi narzędziami [1]. Pracami Galvaniego zainteresował się następnie Allesandro Volta, który udowodnił, że dwa różne metale zanurzone w roztworze elektrolitu stają się źródłem prądu elektrycznego [2].
Dziś najpowszechniej stosowane, chociaż ciągle wypierane przez inne konstrukcje, są ogniwa opracowane w 1866 roku przez francuskiego chemika Georges'a Leclanchégo. Budowę ogniwa w wersji suchej, tj. bez płynnego elektrolitu przedstawia Rys.1.
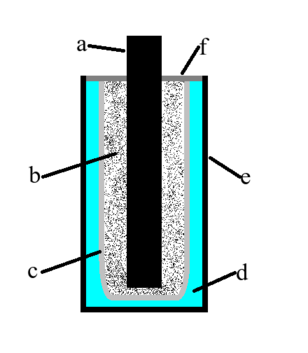
Poza ogniwami Leclanchégo (cynkowo-węglowymi) można spotkać wiele innych typów: ogniwa alkaliczne, litowe i inne.
W większości przypadków budowa sprawnych ogniw galwanicznych wymaga stosowania niebezpiecznych substancji, w tym trujących lub o właściwościach żrących. Nie zachęca to do prób ich konstrukcji w warunkach np. szkolnych. Z tego powodu chciałbym opisać budowę ogniwa glinowo-tlenowego, w przypadku którego nie będzie konieczne korzystanie z toksycznych substancji. Dodatkowo jest ono dosyć nietypowe, ponieważ jedną z jego elektrod jest tlen. W pewnym sensie uzyskamy więc prąd elektryczny z powietrza!
Doświadczenie
Do budowy opisywanego ogniwa glinowo-tlenowego potrzebne są jedynie łatwo dostępne substancje:
- glin Al
- węgiel aktywowany C
- chlorek sodu NaCl
Glin, w technice nazywany też aluminium, jest srebrzystobiałym metalem o stosunkowo niewielkiej gęstości (2,7 g/cm3), doskonałej kowalności i plastyczności. Dobrze przewodzi prąd elektryczny [3]. Do doświadczenia nada się glin w postaci spożywczej folii aluminiowej (Fot.1a).
Tak zwany węgiel aktywowany składa się w przeważającej mierze z bezpostaciowego węgla pierwiastkowego, z domieszką drobnokrystalicznego grafitu oraz popiołu. Jego cechą charakterystyczną jest bardzo duży stopień rozwinięcia powierzchni. Trudno to sobie wyobrazić, ale jeden gram węgla aktywowanego może mieć łączną powierzchnię dochodzącą do 3300m2 (sic!). Dzięki temu jest bardzo dobrym adsorbentem wielu związków chemicznych [4].
Węgiel aktywowany posiada różnorodne zastosowania. W medycynie bywa stosowany przy zatruciach lekami i innymi związkami chemicznymi, w przemyśle chemicznym jako katalizator i nośnik, a także przy konstrukcji filtrów różnego rodzaju. Do naszych celów najlepiej nadaje się substancja w postaci niewielkich ziaren lub granulek (Fot.1b).
Chlorek sodu NaCl to oczywiście najzwyczajniejsza sól kuchenna i możemy się w nią zaopatrzyć w sklepie spożywczym (Fot.1c).
Budowa ogniwa nie jest skomplikowana. Anodę, będącą ujemnym biegunem ogniwa stanowi arkusz folii aluminiowej np. o powierzchni kilkudziesięciu centymetrów kwadratowych (Fot.2A).
Na folię anody należy następnie położyć arkusz bibuły filtracyjnej. Dobrze nadają się w tym celu sączki lub papierowe ręczniki. Bibułę musimy nasączyć nasyconym wodnym roztworem chlorku sodu NaCl (Fot.2B). Na bibułę trzeba z kolei nanieść węgiel aktywowany w postaci równomiernej warstwy o grubości pojedynczych ziaren. Na warstwie węgla umieszcza się kolejny arkusz folii aluminiowej. Arkusz spodni i wierzchni nie mogą się stykać.
Całe ogniwo dobrze jest umieścić na wodoodpornym i nieprzepuszczalnym podłożu, ponieważ może nastąpić przesiąkanie elektrolitu.
Przy takiej konstrukcji ogniwa dolny arkusz folii aluminiowej stanowi jego biegun ujemny, górny zaś dodatni.
Sprawdźmy czy zbudowane w ten sposób ogniwo rzeczywiście wytwarza prąd elektryczny. Dla zapewnienia odpowiedniego kontaktu między drobinami węgla, a górnym arkuszem folii należy go docisnąć jakimś ciężkim przedmiotem, np. większą zlewką wypełnioną wodą (Fot.3, u góry).
Pomiar napięcia ogniwa obciążonego jedynie urządzeniem pomiarowym (miernikiem uniwersalnym) wykazał wartość 0,8V, zaś natężenie prądu zwarcia - nieco ponad 22mA. Nie są to zbyt duże wartości, jednak niewątpliwie ogniwo pracuje przekształcając energię wiązań chemicznych w użyteczną energię elektryczną.
Czy rzeczywiście użyteczną? Spróbujmy zaprząc powstałą energię do jakiejś pracy. Na Fot.4 pokazano podłączony do ogniwa mikrosilnik elektryczny wykorzystywany zwykle do napędu zabawek. W tym przypadku na jego osi osadzono wirnik.
Po odpowiednim ściśnięciu elementów ogniwa ciężkim przedmiotem lub dłonią ogniwo zaczyna wymuszać przepływ prądu elektrycznego przez silniczek – jego wirnik obraca się (Fot.5). By doświadczenie powiodło się zastosowany mikrosilnik musi być przystosowany do zasilania niskim napięciem.
Próby zasilenia opisywanym ogniwem miniaturowych, niskonapięciowych żarówek często nie przynoszą rezultatu. Dzieje się tak, ponieważ poszczególne modele wymagają zwykle natężenia prądu rzędu co najmniej kilkuset miliamperów przy napięciu 2-6V, podczas gdy możliwości źródła są w tym przypadku dużo mniejsze. Wydatne powiększenie powierzchni elektrod daje oczywiście dobre rezultaty, ale bywa problematyczne szczególnie w warunkach szkolnych.
Myślę jednak, że możliwość zasilenia ogniwem glinowo-tlenowym jakiegoś źródła światła byłaby bardzo pożądana, ponieważ stanowi to wyraźnie widoczny, nawet wobec dużego audytorium, efekt zachodzących przemian energetycznych.
Poszukując odpowiedniego sposobu zwróciłem uwagę na powszechnie już dziś wykorzystywane źródło światła jakim są diody elektroluminescencyjne, czyli w skrócie LED (ang. light emitting diode). Są to optoelektroniczne przyrządy półprzewodnikowe, w których zachodzi zjawisko tzw. rekombinacji promienistej, dzięki której energia elektryczna zostaje przetworzona do energii świetlnej [5].
Diody LED wymagają do pracy wielokrotnie niższych wartości natężeń prądu elektrycznego niż żarówki. Niestety, ich minimalne napięcie przewodzenia wynosi od około 2V dla diod emitujących światło podczerwone i czerwone do nawet ponad 3V dla diod białych i niebieskich. Z tego powodu nie ma mowy o bezpośrednim zasileniu diod LED napięciem generowanym przez nasze ogniwo. Można oczywiście zbudować kilka ogniw i połączyć je szeregowo, co też posiada wartość edukacyjną. Istnieje jednak inny sposób – możemy zbudować proste urządzenie dopasowujące wartość napięcia do potrzeb diody LED.
Schemat urządzenia przedstawia Rys.2.
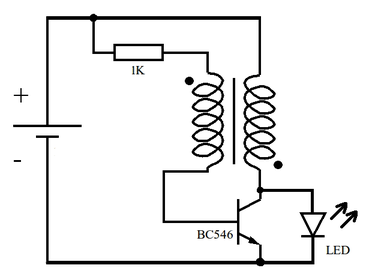
Jak widać, składa się ono jedynie z kilku tanich i łatwo dostępnych elementów elektronicznych – jest to bardzo prosta przetwornica podwyższająca napięcie [6]. W stosunku do częściej spotykanych realizacji zmniejszono wartość rezystora do 1kΩ, tak by układ pracował lepiej przy tak niskich wartościach napięć i natężeń prądu elektrycznego jak w naszym przypadku.
Szerszego omówienia wymaga zastosowany transformator. Najlepiej nawinąć tworzące go uzwojenia bifilarnie, czyli dwoma drutami jednocześnie na miniaturowym rdzeniu toroidalnym. W urządzeniu modelowym zastosowano rdzeń o średnicy zewnętrznej równej 12mm pozyskany z uszkodzonej płyty głównej komputera. Uzwojenia liczą po 27 zwojów drutu nawojowego w emalii o średnicy 0,3mm. Dane uzwojeń nie są krytyczne i można tu poeksperymentować. Swój układ zmontowałem na niewielkim kwadratowym fragmencie uniwersalnej płytki drukowanej (Fot.6). Długość boku płytki wynosi około 2cm, przetwornica jest więc naprawdę miniaturowa. Dla dobrej widoczności zastosowano diodę LED o białej barwie emitowanego światła.
Opisywana przetwornica jest prostym generatorem o sprzężeniu indukcyjnym, w którym dzięki zjawisku indukcji magnetycznej na diodzie LED odkłada się napięcie o wartości wyższej niż napięcie zasilania układu. Łatwo to sprawdzić. Biała dioda LED podłączona bezpośrednio do ogniwa oczywiście nie świeci. Natomiast wykorzystanie układu umożliwia jasne świecenie diody (Fot.7). W przypadku, gdyby przetwornica nie działała należy zamienić miejscami końce jednego z uzwojeń.
Układ zbudowany przez autora działa na tyle sprawnie, że pokuszono się o zbudowanie mocno zminiaturyzowanej wersji prezentowanego ogniwa. Anoda ma wtedy postać paska folii aluminiowej o szerokości około 1cm i długości 4cm. Jeśli chodzi o węgiel aktywowany, to w tym przypadku wystarczy pojedyncze ziarno! Proponuję, by docisnąć je przez warstwę bibuły do folii za pomocą unieruchomionej np. w kombinerkach igły, która stanowi wtedy dodatni biegun ogniwa. Gotowy zestaw przez zwilżeniem bibuły elektrolitem przedstawia Fot.8.
Ogniwo zaczyna pracować oczywiście dopiero po zwilżeniu bibuły elektrolitem. Także w tym przypadku dioda zaczyna wyraźnie świecić (Fot.9).
Zaskakujące jest, że nawet tak uproszczone ogniwo generowało po obciążeniu przetwornicą prąd o natężeniu około 1,2mA przy napięciu 0,6V w czasie przynajmniej 15 minut.
Czas pracy ogniwa zależy od wielu czynników, głównie od ilości glinu użytego na anodę, ponieważ jest on zużywany w czasie pracy. Można to zauważyć badając materiał anody po doświadczeniach z ogniwem: folia staje się wtedy wyraźnie cieńsza, a po pewnym czasie zaczynają się tworzyć w niej otwory. Bibuła oddzielająca anodę od węgla aktywowanego musi być przez cały czas wilgotna – wyschnięcie elektrolitu uniemożliwia pracę ogniwa.
Jak widać, prezentowane proste ogniwo galwaniczne może służyć do wielu interesujących doświadczeń.
Wyjaśnienie
Budowę ogniwa glinowo-tlenowego w przekroju poprzecznym przedstawia Rys.3.
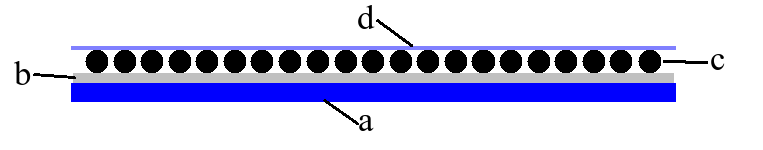
Energia elektryczna w ogniwie powstaje kosztem reakcji chemicznych, jakim ulegają materiały elektrodowe, tj. glin wchodzący w skład folii aluminiowej i tlen z powietrza zaadsorbowany na powierzchni ziaren węgla aktywowanego.
Sumarycznie w ogniwie zachodzi reakcja utleniania glinu tlenem z powietrza przy udziale wody:
Jest to oczywiście reakcja redoks. Istotą pracy ogniwa jest fakt przestrzennego rozdzielenia reakcji utleniania i redukcji, czyli tzw. reakcji połówkowych. Na anodzie zachodzi reakcja utleniania glinu:
Natomiast na katodzie tlen z powietrza jest redukowany do jonów wodorotlenkowych:
Materiały elektrod zużywają się oczywiście w czasie reakcji, ponieważ zostają przetworzone w odpowiednie produkty [7].
Dzięki uwalnianiu elektronów na anodzie i ich pochłanianiu na katodzie, między elektrodami powstaje różnica potencjałów. Po połączeniu elektrod ogniwa przewodnikiem zaczyna więc płynąć prąd elektryczny, mogący wykonać określoną pracę.
Szanowny Czytelnik przyzna z pewnością, że tlen wydaje się dosyć nieporęczny jako materiał na elektrodę ogniwa. Pamiętajmy, że gazowy tlen praktycznie nie przewodzi prądu elektrycznego. Z pomocą przychodzi nam tutaj węgiel aktywowany – dzięki silnie rozwiniętej powierzchni i zdolności do absorpcji sprawdza się doskonale jako rezerwuar gazu. Przewodzi też dosyć dobrze prąd elektryczny, dzięki czemu umożliwia odbiór ładunków, które są przekazywane dalej do górnej warstwy folii aluminiowej. Pełni ona jedynie rolę kolektora ładunków z poszczególnych ziaren węgla i nie uczestniczy w reakcjach chemicznych.
Tak zbudowane ogniwo ma dosyć wysoki opór wewnętrzny, m.in. z powodu małej powierzchni kontaktu ziaren grafitu z kolektorem. Ściśnięcie ogniwa powoduje polepszenie styku i zmniejszenie oporu wewnętrznego ogniwa, co pociąga za sobą możliwość uzyskiwania większych natężeń prądu.
Czy rzeczywiście w reakcji jest zużywany tlen? Można się o tym przekonać szczególnie łatwo w miniaturowej wersji ogniwa (Fot.8, Fot.9), pokrywając ziarno węgla aktywnego np. parafiną. Blokuje ona dostęp powietrza, przez co zapas tlenu zostaje stosunkowo szybko zużyty i ogniwo przestaje pracować.
Ogniwo glinowo-tlenowe nie jest jedynie laboratoryjną ciekawostką. Jest ono brane pod uwagę (oczywiście po daleko idących modyfikacjach) jako źródło energii np. w samochodach elektrycznych [8].
Literatura:
- [1] Galvani L., De viribus electricitatis in motu musculari commentarius, De Bononiensi Scientiarum et Artium Instituto atque Academia Commentarii, 1791, vol. VII, str. 363–418 powrót
- [2] Pancaldi G., The Battery, w: Volta: Science And Culture In The Age Of Enlightenment, Princeton Universyty Press, 2005, str. 178 - 189 powrót
- [3] Lide D.R., CRC Handbook of Chemistry and Physics, CRC Press, 2009, str. 40-44 powrót
- [4] Dillon E.C., Wilton J.H., Barlow J.C., Watson W.A., Large surface area activated charcoal and the inhibition of aspirin absorption, Annals of Emergency Medicine, 1989, 18(5), str. 547–552 powrót
- [5] Moss S.J., Ledwith A., The Chemistry of the Semiconductor Industry, Springer, 1987 powrót
- [6] Ples M., Joule thief, w serwisie: www.weirdscience.eu, dostępne online: http://weirdscience.eu/Joule%20thief.html [dostęp: 22.09.2016] powrót
- [7] Fitzpatrick N., Smith F., Jeffrey P., The Aluminum-Air Battery, SAE Technical Paper, 1983 powrót
- [8] Yang S., Design and analysis of aluminum/air battery system for electric vehicles, Journal of Power Sources, 2002, 112, str. 162–201 powrót
Marek Ples








