Kto pomieszał cukry?
| English version is here |
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (1/2018):

Mała analiza
Siła życiowa, albo z łaciny vis vitalis, to termin wywodzący się z koncepcji alchemicznych i wprowadzony w XVI wieku przez Johanna Baptistę van Helmonta - flamandzkiego lekarza i fizjologa. Według wielu to właśnie ów uczony rozpoczął proces, którego rezultatem było przekształcenie się alchemii w chemię jako naukę, którą znamy dzisiaj [1]. Pojęcie vis vitalis oznaczało bliżej nieokreśloną tajemniczą siłą istniejącą w ustrojach żywych. Miała ona nadawać zdolność do syntezy organicznych związków chemicznych.
Powodem sformułowania pojęcia siły życiowej był fakt, że mimo potwierdzenia istnienia specyficznych związków chemicznych występujących w żywych organizmach badacze początkowo nie potrafili ich syntezować w warunkach laboratoryjnych. Dopiero Friedrich Wöhler w 1828 roku dokonał syntezy będącego związkiem organicznym mocznika CO(NH2)2 z nieorganicznych substratów takich jak amoniak NH3 i kwas cyjanowy HOCN [2]. Tym samym dowiódł, że istnienie vis vitalis nie jest konieczne do powstania tych związków. Z tego powodu wspomnianą datę przyjmuje się często za początek współczesnej chemii organicznej.
Znalezienie jednej metody klasyfikacji olbrzymiej liczby związków organicznych napotyka na wiele trudności. Wystarczy wspomnieć, że ich prosta definicja jako połączeń chemicznych zawierających węgiel powoduje wiele problemów interpretacyjnych. Proste związki (dwutlenek węgla CO2, kwas węglowy H2CO3, cyjanowodór HCN i inne) nie są zaliczane do związków organicznych. Także inne, bardziej skomplikowane definicje bywają obarczone pewnymi nieścisłościami. Wynika to z faktu, że nie istnieje ścisłe rozgraniczenie między związkami organicznymi a nieorganicznymi.
Ponad wszelką wątpliwość do związków organicznych należą jednak węglowodany nazywane też często cukrami lub sacharydami. Składają się one z atomów węgla C oraz wodoru H i tlenu O, zazwyczaj w stosunku H:O = 2:1. Do charakterystycznych grup występujących w strukturze cukrów można zaliczyć grupy hydroksylowe, karbonylowe i mostki półacetalowe.
Węglowodany można podzielić m. in. na:
- cukry proste (monosacharydy),
- oligosacharydy,
- wielocukry (polisacharydy).
Cukry proste można także rozróżniać ze względu na ilość występujących w nich atomów węgla. Tak więc istnieją triozy (3 atomy węgla, np. aldehyd glicerynowy C3H6O3), tetrozy (np. treoza C4H8O4), pentozy (np. rybuloza C5H10O5), heksozy (np. glukoza C6H12O6) i heptozy (np. mannoheptuloza C7H14O7).
Inną metodą klasyfikacji cukrów prostych jest podział ze względu na występujące grupy funkcyjne:
- ketozy – posiadające grupę ketonową (=C=O),
- aldozy – posiadające grupę aldehydową (-CHO).
Do ketoz należy m.in. wspomniana wcześniej rybuloza, zaś do aldoz np. glukoza.
Cukry złożone czyli oligo- i polisacharydy powstają poprzez połączenie dwóch lub więcej reszt cukrów prostych za pomocą wiązania glikozydowego. W ten sposób z glukozy i fruktozy powstaje sacharoza C12H22O11 – powszechnie wykorzystywany cukier spożywczy.
Większość cukrów, z jakimi możemy się zetknąć w naszym otoczeniu ma podobną formę – w temperaturze pokojowej są to krystaliczne lub bezpostaciowe ciała o białej barwie. Mimo jednak podobnego wyglądu cukry bardzo często różnią się od siebie np. właściwościami chemicznymi. Z tego powodu chciałbym dziś opisać proste metody rozróżniania cukrów, które można z powodzeniem zastosować w szkolnej lub uczelnianej pracowni. Tego rodzaju prosta analiza chemiczna związków czynnych biologicznie może stanowić doskonały sposób ukazania łączności między dwiema naukami przyrodniczymi, jakimi są biologia i chemia.
Rozpoznajemy cukry
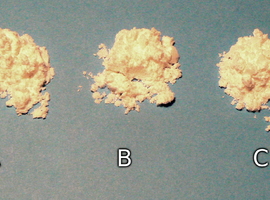
W doświadczeniu wykorzystamy trzy łatwo dostępne cukry. Będzie to sacharoza, glukoza nazywana też cukrem gronowym i fruktoza znana jako cukier owocowy. Wszystkie trzy cukry po utarciu w moździerzu na jednorodny proszek właściwie nie różnią się z wyglądu. Jak widać na Fot.1 nie można ich w ten sposób odróżnić. Nie zdradzę teraz, który z cukrów (Fot.1A, B, C) jest sacharozą, glukozą czy fruktozą.
Wszystkie przedstawione cukry mają słodki smak i dobrze rozpuszczają się w wodzie. Dla ułatwienia interpretacji we wszystkich próbach oraz przedstawiających je zdjęciach zostaną zachowane oznaczenia odpowiadające Fot.1.
Aby rozróżnić wspomniane substancje należy uciec się do metod chemicznych. W tym celu wykonamy odpowiednie reakcje charakterystyczne. Pierwszą z nich będzie próba Fehlinga, która umożliwia wykrywanie związków redukujących. Została ona opracowana w XIX wieku przez niemieckiego chemika Hermanna von Fehlinga [3].
Wykorzystanie próby Fehlinga do rozróżniania cukrów opiera się na fakcie, że niektóre z nich posiadają zdolność do redukcji innych substancji. Z wykorzystanych w doświadczeniu cukrów zarówno glukoza, jak i fruktoza są cukrami redukującymi - w przeciwieństwie do sacharozy.
Głównym składnikiem potrzebnego w tej próbie odczynnika jest sól miedzi(II), a konkretnie siarczan(VI) miedzi(II) w postaci pentahydratu CuSO4 • 5H2O. Jest to ciało krystaliczne o pięknej niebieskiej barwie (Fot.2).
Do ciekawostek należy zaliczyć fakt, że substancja ta była znana alchemikom i nazywana witriolem miedzi (łac. Vitriol coeruleum). Nazwa tej substancji może kojarzyć się także z popularnym wśród adeptów tajemnych sztuk mottem łacińskim Visita Interiora Terrae Rectificando Invenies Occultum Lapidem (Odwiedź wnętrze Ziemi, dzięki oczyszczeniu znajdziesz tam ukryty kamień).
By przeprowadzić próbę Fehlinga należy najpierw sporządzić dwa roztwory. Ich skład przedstawia się następująco:
- roztwór A – 2g NaOH i 1g NaKC4H4O6 w 50cm3 H2O
- roztwór B – 2g CuSO4 • 5H2O w 40cm3 3% H2SO4
Do przygotowania roztworów należy oczywiście użyć wody destylowanej.
Wykorzystany winian potasu sodu NaKC4H4O6 (sól Seignette’a, sól z Rochelle) nie jest trujący, ale pracując z pozostałymi substancjami należy zachować ostrożność. Siarczan(VI) miedzi(II) może być szkodliwy, natomiast zarówno kwas siarkowy(VI), jak i wodorotlenek sodu są żrące – mogą spowodować trudno gojące się oparzenia, a w razie dostania się do oczu uszkodzić wzrok.
Gotowy roztwór A jest bezbarwny, natomiast roztwór B zawdzięcza swoją błękitną barwę obecności związku miedzi (Fot.3).
Oba roztwory można długo przechowywać w zamkniętych naczyniach. Bardzo odpowiednie w tym celu są niewielkie butelki ze szkła lub tworzywa sztucznego umożliwiające dozowanie po kropli (Fot.4). Trzeba je oczywiście odpowiednio podpisać.
Odczynnik Fehlinga przygotowuje się bezpośrednio przed przeprowadzeniem próby łącząc w odpowiednich proporcjach otrzymane roztwory A oraz B.
Do probówki należy wlać kilka centymetrów sześciennych roztworu A, a następnie - ciągle mieszając - dodać kilka kropli roztworu B. Odczynnik Fehlinga jest gotowy, kiedy ciecz przybierze trwałą barwę błękitną (nieco intensywniejszą niż barwa samego roztworu B).
Chcemy zidentyfikować trzy cukry. Dlatego weźmiemy taką samą ilość probówek, w których przygotujemy na świeżo odczynnik Fehlinga. Do każdej z nich należy dodać po szczypcie badanego cukru. Po rozpuszczeniu substancji stałych w dalszym ciągu nie można zaobserwować żadnej różnicy (Fot.5).
By zaobserwować różnice charakterystyczne dla określonych cukrów należy ogrzać probówki w łaźni wodnej lub za pomocą palnika spirytusowego (Fot.6).
W przypadku ogrzewania palnikiem trzeba uważać, tak by nie spowodować rozprysku gorącej cieczy.
Już po chwili ogrzewania można zauważyć interesujący fenomen – ciecz zmienia swą barwę z niebieskiej na pomarańczowoczerwoną, stając się przy tym mętna. Zmiana ta występuje jednak tylko w pierwszej i drugiej probówce. W trzecim naczyniu mimo ogrzewania ciecz pozostaje niebieska i klarowna (Fot.7).
Brak zmiany zabarwienia (wynik negatywny) w przypadku próbki C świadczy jednoznacznie, że zawierała ona sacharozę. Tym sposobem zidentyfikowaliśmy ten cukier.
Za pomocą próby Fehlinga nie da się natomiast rozróżnić glukozy i fruktozy, ponieważ obie dają pozytywny wynik, tj. mają właściwości redukujące. Trzeba w tym celu wykorzystać inną metodę.
W celu łatwej identyfikacji tych cukrów można wykorzystać fakt, że glukoza jest aldozą, zaś fruktoza ketozą. Różnice w ich właściwościach chemicznych można wykazać za pomocą tzw. próby Seliwanowa opracowanej przez rosyjskiego chemika Fiodora Seliwanowa w 1887 roku [4].
Przygotowanie odczynnika Seliwanowa nie jest trudne. Jest do tego potrzebny kwas chlorowodorowy HCl – jego stężenie powinno wynosić około 18%. Kolejną konieczną substancją jest 1,3-dihydroksybenzen C6H4(OH)2, którego wzór strukturalny przedstawia Rys.1.
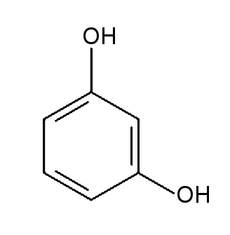
Wspomniana substancja jest też często nazywana rezorcyną. W warunkach normalnych ma ona postać białego proszku lub łusek, które w kontakcie z powietrzem nabierają powoli delikatnego zabarwienia różowego (Fot.8).
Chcąc przygotować odczynnik Seliwanowa należy do niewielkiej ilości kwasu chlorowodorowego o odpowiednim stężeniu dodać kilka kropli alkoholowego roztworu rezorcyny. Tak uzyskany roztwór jest praktycznie bezbarwny (Fot.9).
W naszym przypadku roztwór należy rozlać do probówek, a następnie do każdej z nich dodać szczyptę badanych substancji. Podobnie jak przy reakcji Fehlinga, na zimno nie można zaobserwować żadnych różnic w wyglądzie próbek (Fot.10).
Znowu więc musimy ogrzać obie próbki. Odpowiednia będzie tutaj prosta łaźnia z gorącą wodą, wykonana np. z większej zlewki (Fot.11).
Już po kilku sekundach można zauważyć, że w jednej z probówek szybko powstaje intensywne czerwone zabarwienie. Wynik próby przedstawia Fot.12.
Jako pozytywny wynik próby interpretujemy szybkie powstanie intensywnego zabarwienia (Fot.12B). Delikatne zabarwnienie (Fot.12A) powstające po dłuższym ogrzewaniu lub całkowity jego brak należy zinterpretować jako wynik negatywny.
Pozytywny wynik świadczy o tym, że badany cukier był ketozą, a więc próbka B zawierała fruktozę.
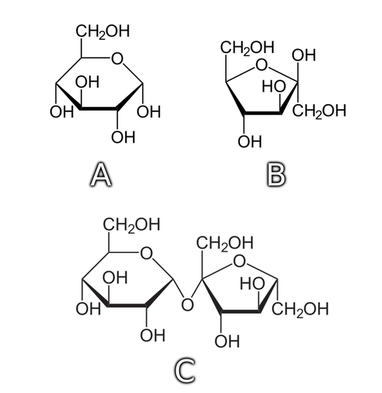
Łącząc informacje uzyskane dzięki przeprowadzeniu prób Fehlinga i Seliwanowa możemy więc stwierdzić, że pod oznaczeniami A, B, C (vide Fot. 1) kryły się odpowiednio: glukoza, fruktoza i sacharoza.
Jako swego rodzaju uzupełnienie chciałbym tutaj przytoczyć także wzory strukturalne badanych cukrów, oczywiście w teraz już znanej kolejności (Rys.2).
Wyjaśnienie
W reakcji Fehlinga obecne w roztworze jony miedzi(II) Cu2+ - przedstawione jako jony proste, w rzeczywistości jednak w postaci kompleksu winianowego - w obecności zasady reagują ze związkiem zawierającym grupę aldehydową. Dzięki temu metal zostaje zredukowany i powstaje nierozpuszczalny tlenek miedzi(I) Cu2O o barwie czerwonopomarańczowej:
Jednocześnie aldehyd zostaje utleniony do odpowiedniego kwasu karboksylowego, czy raczej (z powodu obecności zasady) do soli sodowej tego kwasu [5]. W przypadku cukrów powstają w ten sposób sole sodowe kwasów aldonowych, np. glukonian sodu.
Wydawałoby się, że metoda ta powinna pozwalać jedynie na wykrywanie redukujących właściwości aldoz, a więc także na odróżnienie ich od ketoz jako nie zawierających grupy aldehydowej. Niestety tak nie jest, ponieważ wiele ketoz ulega tautomerii keto-enolowej, dzięki czemu mogą podobnie jak aldozy wykazywać właściwości redukujące.
Jak widzimy, cukry proste i disacharydy najczęściej dają pozytywny wynik próby Fehlinga. Do wyjątków należy sacharoza, co wykorzystaliśmy w doświadczeniu. Wielocukry dają negatywny wynik ze względu na małą liczbę reszt redukujących w długim łańcuchu polimeru.
Jeśli chodzi o próbę Seliwanowa, to opiera się ona na fakcie, że ketozy znacznie łatwiej przekształcają się pod działaniem kwasu chlorowodorowego w pochodne furfuralowe niż aldozy. Wspomniana pochodna reaguje następnie z rezorcyną, czego efektem jest powstanie czerwonego produktu. Aldozy także mogą ulegać podobnej reakcji, ale czynią to o wiele wolniej. Dlatego metoda pozwala na rozróżnianie ketoz od aldoz [6].
Zaznaczyć należy, że sacharoza jako dwucukier, w skład którego wchodzą reszty glukozy i fruktozy daje pozytywny wynik testu Seliwanowa.
Literatura:
- [1] Encyclopedia Britannica, dostępne online: https://www.britannica.com/biography/Jan-Baptista-van-Helmont (dostęp: 15.12.2017) powrót
- [2] Wöhler F., Ueber künstliche Bildung des Harnstoffs, Annalen der Physik und Chemie, 88 (2), 1828, str. 253-256 powrót
- [3] von Fehling H., Die quantitative Bestimmung von Zucker und Stärkmehl mittelst Kupfervitriol, Justus Liebigs Annalen der Chemie, 72, 1849, str. 106-113 powrót
- [4] Seliwanoff Th., Notiz über eine Fruchtzuckerreaction, Berichte der deutschen chemischen Gesellschaft, 20, 1887, str. 181 powrót
- [5] Fieser L. F., Fieser M., Advanced Organic Chemistry, Chapman & Hall, 1962, str. 425 powrót
- [6] Katoch R., Analytical Techniques in Biochemistry and Molecular Biology, Springer-Verlag New York, 2011 powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples