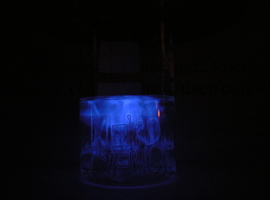
Chemiluminescencja luminolu aktywowana miedzią
Korozja miedzi
Chemiluminescencja jest rodzajem luminescencji, w której promieniowanie widzialne powstaje w następstwie reakcji chemicznych. Jest to reakcja egzoenergetyczna, więc energia wewnętrzna produktów jest niższa niż substratów. Zgodnie z zasadą zachowania, energia nie może zniknąć bezpowrotnie, ani powstać z niczego. Z tego powodu różnica energii reagentów musi zostać oddana do środowiska w tej czy innej formie. Najczęściej dzieje się to na sposób ciepła, ale w przypadku luminescencji pewna część energii zostaje wypromieniowana w postaci promieniowania elektromagnetycznego o długości odpowiadającej światłu widzialnemu. Do substancji reagujących w ten sposób można zaliczyć singletową formę tlenu, lucyferynę, białą odmianę alotropową fosforu, lofinę, układ pirogalol-formaldehyd i inne.
Substancją o najsilniejszych właściwościach chemiluminescencyjnych jest 3-aminohydrazyd kwasu ftalowego czyli krócej luminol. Świecenie luminolu może być wyzwalane związkami żelaza, na przykład żelazicyjankiem lub zawartym w hemoglobinie krwi hemem.
Okazuje się jednak, że podobną rolę może pełnić miedź; jej kompleksy także mogą pełnić rolę inicjatora świecenia w reakcji utleniania luminolu.
Potrzebne materiały
Do przeprowadzenia doświadczenia potrzebujemy:
- Nadtlenek wodoru H2O2 30% (perhydrol),
- wodorotlenek sodu NaOH,
- 3-aminohydrazyd kwasu ftalowego (luminol) C8H7N3O2,
- woda amoniakalna NH3,
- miedź Cu.
Ostrzeżenie: W tym doświadczeniu wykorzystywany jest NaOH, który jest mocną zasadą i ma silne działanie żrące. Perhydrol jest także żrący; w zetknięciu ze skórą wywołuje zmiany martwicze. Luminol ma działanie alergogenne i jest podejrzewany o właściwości rakotwórcze! Amoniak jest bardzo lotny; ma działanie drażniące, a w większych stężeniach jest trujący. Należy bezwzględnie unikać zanieczyszczenia oczu lub skóry! Konieczne jest stosowanie rękawic i okularów ochronnych! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
3-aminohydrazyd kwasu ftalowego, bardziej znany jako luminol, jest niestety stosunkowo drogim odczynnikiem. Na szczęscie jednak są potrzebne bardzo małe jego ilości, więc nawet pół grama tej substancji wystarczy do przeprowadzenia wielu ciekawych reakcji. Jego wzór strukturalny:
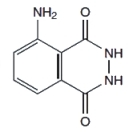
Można go też samemu zsyntezować, lecz wymaga to nieco zachodu. Dla chcącego nie ma nic trudnego! Dla tych, którzy chcieliby samodzielnie uzyskać tę substancję, zamieszczam opis przeprowadzonej przeze mnie syntezy luminolu. Poniżej zdjęcie próbki otrzymanego w ten sposób związku, który został wykorzystany także w tym doświadczeniu.
Możemy użyć miedzi w dowolnej formie, jednak najwygodniejszy jest czysty drut miedziany bez izolacji. Należy go przeczyścić drobnoziarnistym papierem ściernym.
Doświadczenie
Musimy przygotować odpowiedni roztwór. W 50cm3 wody destylowanej rozpuszczamy 1g NaOH, a następnie kilka miligramów luminolu (taka ilość będzie wystarczająca, nie ma potrzeby stosować więcej). Luminol stosunkowo opornie rozpuszcza się w wodzie, dlatego konieczne jest mieszanie aż do rozpuszczenia. Następnie dodajemy 1cm3 perhydrolu. Roztwór jest nietrwały, musi być przygotowywany bezpośrednio przed doświadczeniem.
Jednocześnie musimy porzygotować drut miedziany. Dla lepszego efektu można go wygiąć w jakiś interesujący kształt. Ja zdecydowałem się na uformowanie drutu w nazwę niniejszej strony:
Drut umieszczamy w przygotowanym wcześniej roztworze, jak to widać poniżej:
Kolejną rzeczą jaką musimy zrobić jest zaciemnienie pomieszczenia. Po dodaniu kilku cm3 wody amoniakalnej rozpoczyna się reakcja.
Roztwór wokół powierzchni drutu zaczyna emitować niebieskie światło, a po jakimś czasie świeci już cały roztwór. Zjawisko bardzo dobrze prezentuje się także na zdjęciach poniżej.
Drut można uformować także w inne kształty.
Wyjaśnienie
Mechanizm zachodzących procesów polega na utlenianiu luminolu w środowisku zasadowym za pomocą H2O2 w obecności katalizatora. Dokładny opis tego procesu zawarłem tutaj. Katalizatorem reakcji jest tutaj miedź, a dokładniej jej amoniakalny kompleks.
Na powiechni miedzi w reakcji z amoniakiem w obecności H2O2 powstaje kompleksowy jon Cu(NH3)42+. Pod jego wpływem dochodzi do utleniania luminolu, co w środowisku zasadowym jest źródłem intensywnej luminescencji o barwie niebieskiej.
Życzę miłej i pouczającej zabawy:)
Marek Ples