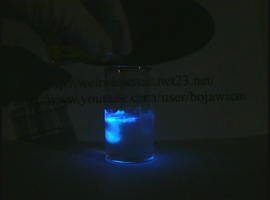
Chemiluminescencja luminolu aktywowana żelazicyjankiem
Chemiczne światło
Spójrzmy na sytuację z książki Carrola oczami jego bohaterki:
Zapytałam dziecko niosące świeczkę:
-Skąd pochodzi to światło?
Chłopczyk natychmiast ją zdmuchnął.
- Powiedz mi, dokąd teraz odeszło - odparł. - Wtedy ja powiem ci, skąd pochodzi.
Właśnie! Skąd pochodzi światło? Chemik czy fizyk musi potraktować sprawę ze ścisłym podejściem. Wtedy to pytanie okaże się już nie takie trudne.
Światło to promieniowanie elektromagnetyczne, jest więc formą energii. Dlatego musi brać swój początek w przemianach innych jej rodzajów. Światło może powstawać kosztem energii cieplnej; odpowiednio rozgrzana substancja (np. metal) zaczyna świecić, co wykorzystujemy powszechnie w celach oświetleniowych; tak działa przecież zwykła żarówka! Innym sposobem wytwarzania światła jest bezpośrednia przemiana energii elektrycznej, na przykład w diodach elektroluminescencyjnych LED. Rzadziej wykorzystywaną możliwością jest bezpośrednie przekształcanie energii chemicznej w świetlną, które to zjawisko nosi miano chemiluminescencji.
Wiele substancji wykazuje zdolność do chemiluminescencji, między innymi lucyferyna z lucyferazą, biały fosfor, singletowa odmiana tlenu, lofina czy układ pirogalol-formaldehyd. Najsilniejszą luminescencję daje utleniany w środowisku alkalicznym luminol. I to właśnie wykorzystamy w dzisiejszym doświadczeniu.

Czego potrzebujemy?
Musimy zgromadzić substancje z poniższej listy.
- Nadtlenek wodoru H2O2 30% (perhydrol),
- wodorotlenek sodu NaOH,
- 3-aminohydrazyd kwasu ftalowego (luminol) C8H7N3O2,
- heksacyjanożelazian(III) potasu (żelazicyjanek potasu) K3[Fe(CN)6].
Ostrzeżenie: W tym doświadczeniu wykorzystywany jest NaOH, który jest mocną zasadą i ma silne działanie żrące. Perhydrol jest także żrący; w zetknięciu ze skórą wywołuje zmiany martwicze. Luminol ma działanie alergogenne i jest podejrzewany o właściwości rakotwórcze! Należy bezwzględnie unikać zanieczyszczenia oczu lub skóry! Konieczne jest stosowanie rękawic i okularów ochronnych! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
3-aminohydrazyd kwasu ftalowego, bardziej znany jako luminol, jest niestety stosunkowo drogim odczynnikiem. Na szczęscie jednak są potrzebne bardzo małe jego ilości, więc nawet pół grama tej substancji wystarczy do przeprowadzenia wielu ciekawych reakcji. Jego wzór strukturalny:
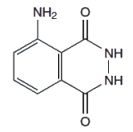
Można go też samemu zsyntezować, lecz wymaga to nieco zachodu. Dla chcącego nie ma nic trudnego! Dla tych, którzy chcieliby samodzielnie uzyskać tę substancję, zamieszczam opis przeprowadzonej przeze mnie syntezy luminolu. Poniżej zdjęcie próbki otrzymanego w ten sposób związku, który został wykorzystany także w tym doświadczeniu.
Heksacyjanożelazian(III) potasu jest nieorganicznym związkiem chemicznym, solą kompleksową potasu. Poniżej możemy zobaczyć jego wzór strukturalny.
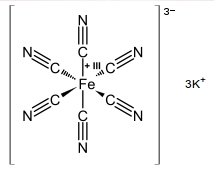
Substancja ta ma postać intensywnie czerwonych kryształów:
Mając już wszystko co potrzebne, możemy przystąpić do doświadczenia.
Doświadczenie
Musimy przygotować odpowiedni roztwór. W 50cm3 wody destylowanej rozpuszczamy 1g NaOH, a następnie kilka miligramów luminolu (taka ilość będzie wystarczająca, nie ma potrzeby stosować więcej). Luminol stosunkowo opornie rozpuszcza się w wodzie, dlatego konieczne jest mieszanie aż do rozpuszczenia. Następnie dodajemy 1,5cm3 perhydrolu. Roztwór jest nietrwały, musi być przygotowywany bezpośrednio przed doświadczeniem.
Potem przygotowujemy drugi roztwór: w małej ilości wody rozpuszczamy kilka małych kryształków heksacyjanożelazianu(III) potasu K3[Fe(CN)6]. Inicjacja reakcji polega na zmieszaniu obu roztworów. Można też bezpośrednio wrzucić kryształy K3[Fe(CN)6] do pierwszego roztworu i zamieszać. Doświadczenie ukazuje mój film:
Po dodaniu K3[Fe(CN)6] natychmiast rozpoczyna się silna emisja niebieskiego światła, która trwa kilka do kilkudziesięciu sekund. Efekt wspaniale prezentuje się także na zamieszczonych niżej zdjęciach.
Interesujący efekt można uzyskać wrzucając do roztworu luminolu pojedynczy, stosunkowo duży kryształ heksacyjanożelazianu(III) potasu. Obserwuje się wtedy unoszącą się z powierzchni kryształu smugę chemiluminescencji:
Zamiast dodawać katalizator w postaci stałej można użyć jego roztworu:
Wyjaśnienie
Emisja światła w tej reakcji jest dosyć skomplikowanym procesem i zachodzi etapowo. W zasadowym roztworze luminol dysocjuje do postaci dwuujemnego anionu. Jest to jednak bardziej skomplikowane niż się wydaje, ponieważ ma miejsce tutaj tautomeria keto-enolowa:
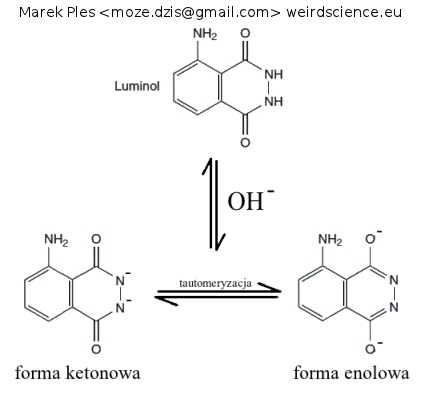
Jak widzimy powyżej, na drodze dysocjacji luminolu powstają dwie różniące się budową i rozmieszczeniem ładunku ujemnego formy: ketonowa, gdzie ładunek ujemny jest zlokalizowany na atomach azotu, oraz enolowa, gdzie ładunek ten jest zgromadzony na atomach tlenu. Obie formy istnieją w stanie równowagi dynamicznej, w sposób ciągły przechodząc jedna w drugą.
Dalszej reakcji ulega mniej trwała forma enolowa. Zostaje ona utleniona w środowisku alkalicznym (zapewnianym przez NaOH) przez nadtlenek wodoru H2O2, w obecności heksacyjanożelazianu(III) potasu K3[Fe(CN)6], jako katalizatora:
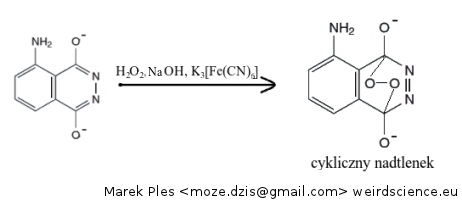
Produktem jest cykliczny nadtlenek. Z racji istnienia w jego strukturze mostku nadtlenkowego związek ten jest bardzo nietwały. Dochodzi do spontanicznego rozpadu, czego produktem jest cząsteczka azotu oraz 3-aminoftalan. Co ważne, ten ostatni związek powstaje w stanie wbudzonym:
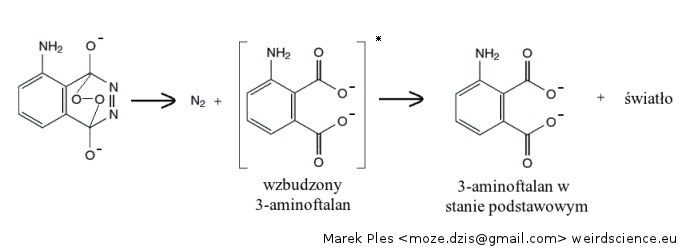
Stan wzbudzony jest stanem, w którym cząsteczka (lub jon) posiada większą energię niż w stanie podstawowym. Jak łatwo się domyślić, stan wzbudzony z termodynamicznego punktu widzenia jest niestabilny; dochodzi do spontanicznego przejścia do stanu podstawowego. Zgodnie z zasadą zachowania nadwyżka energii zostaje wypromieniowana do środowiska pod postacią światła, tutaj niebieskiego.
Trzeba też zaznaczyć, że woda silnie wygasza chemiluminescencję luminolu. O wiele lepsze wyniki osiąga się prowadząc reakcję w polarnych rozpuszczalnikach niewodnych, na przykład w dimetylosulfotlenku DMSO.
Luminol może być teś stosowany w kryminalistyce przy wykrywaniu śladów krwi, co opisałem tutaj.
Życzę miłej i pouczającej zabawy:)
Marek Ples