Termochromia jodku ołowiu: czerwone czy żółte?
Wspomnijmy na początku słowa klasyka:
Barwa jest cierpieniem światła.
Trzeba przyznać Goethemu, że udało mu się przeczuć rzeczywistość na długo przed potwierdzającymi je odkryciami naukowymi i ubrać ją w poetyckie słowa, co tylko potwierdza jego geniusz jako poety i filozofa.
Świat kolorów w chemii ma podstawę w zmianach stanów energii układów elektronowych cząstek. Barwność jest wynikiem pochłaniania fal elektromagnetycznych z zakresu widzialnego, o określonej długości. Powodem występowania kolorów substancji chemicznych jest zwykle istnienie elektronów zdelokalizowanych wiązań typu π lub niesparowanych elektronów w rodnikach. Istnieją też inne możliwości, o których jednak nie będziemy tu wspominać.
Wiele pierwiastków i związków chemicznych wykazuje polimorfizm, czyli wielopostaciowość. Mogą one istnieć w różnych formach, zależnych od warunków. Szczególnie ważna jest tu temperatura. Po przekroczeniu pewnej określonej temperatury substancja stała może dokonać przemiany fazowej w inną formę, czemu może towarzyszyć zmiana barwy! Zjawisko to nosi nazwę termochromii. Zmiana barwy może być odwracalna lub nieodwracalna.
Efekt termochromowy może być zaobserwowany w przypadku wielu substancji, jedną z nich jest jodek ołowiu(II) PbI2.
Czego potrzebujemy?
Do doświadczenia potrzebujemy jedynie jodku ołowiu(II) PbI2. Możemy go z łatwością otrzymać własnoręcznie, ponieważ jego synteza jest bardzo prosta. Potrzebujemy wtedy:
- Jodek potasu KI,
- azotan(V) ołowiu(II) Pb(NO3)2.
Ostrzeżenie: Związki ołowiu są silnie toksyczne! Nie wolno dopuścić do ich kontaktu ze skórą! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Do roztworu azotanu(V) ołowiu(II) dodajemy kroplami roztwór jodku potasu, póki będzie się wytrącał osad jodku ołowiu(II) PbI2 według równania reakcji podwójnej wymiany:
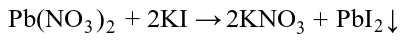
Użyte roztwory sa bezbarwne, zaś powstający jodek ma barwę intensywnie żółtą:

Osad należy przepłukać kilkakrotnie przez dekantację, następnie odsączyć i wysuszyć. Ma on postać lekkiego, żółtego proszku.
Tak przygotowany jodek ołowiu(II) PbI2 może zostać z powodzeniem użyty do doświadczenia.
Pokaz!
Przygotowanie doświadczenia jest proste. Probówkę trzeba umieścić w łapie statywu, a następnie wsypać do niej odrobinę jasnożółtego jodku ołowiu(II) PbI2
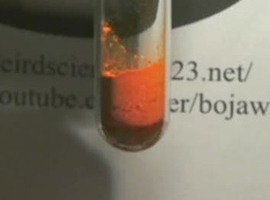
Probówkę trzeba potem delikatnie ogrzewać płomieniem palnika. Wraz ze wzrostem temperatury zawartość probówki zmienia barwę na czerwoną! Można to zobaczyć na poniższym zdjęciu:
Zmiana jest wyraźnie widoczna, lecz jeszcze łatwiej można ją zauważyć na poniższym ujęciu, zmontowanym z dwóch zdjęć wykonanych w różnej temperaturze.
Zjawisko jest w pełni odwracalne; po ochłodzeniu powraca barwa żółta.
Wyjaśnienie
Prezentowana zmiana barwy jest przykładem termochromii. Dochodzi tu do przemiany stabilnej w temperaturze pokojowej formy jodku ołowiu(II) PbI2 w inną, stabilniejszą w wyższej temperaturze. Obie postaci związku różnią się barwą, obserwujemy więc jej zmianę uzależniona od temperatury.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Bukleski M., Petruševski V. M., Preparation and Properties of a Spectacular Thermochromic Solid, Journal of Chemical Education, 86 (1), 2009, str. 30,
- Domka F., Chemiczne metody analizy jakościowej, Wydawnictwo Naukowe UAM, Poznań, 2000, str. 79-81, 161-165.
Marek Ples