Obserwacja efektów aktywności katalitycznej amylazy ślinowej
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (3/2023):

Enzymy wokół nas
Żywy organizm składa się z materii tego samego rodzaju co wszystkie otaczające nas przedmioty. Nic więc dziwnego, że w jego strukturze bardzo ważną funkcję pełnią swoiste związki chemiczne. Jednymi z najważniejszych są enzymy.
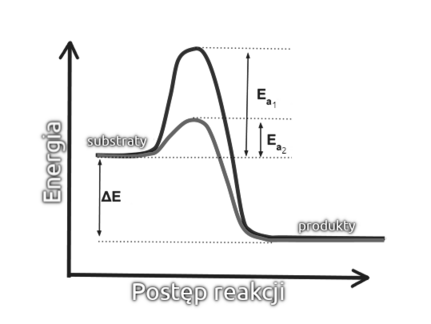
Enzymy to wielkocząsteczkowe, w większości białkowe katalizatory. Katalizatorami zwiemy zaś związki chemiczne, które mogą przyspieszyć przebieg reakcji pozornie same w niej nie uczestnicząc – oczywiście w rzeczywistości cząstka katalizatora bierze udział w procesach chemicznych i ulega pewnym przekształceniom, jednak w toku reakcji ulega na końcu odtworzeniu w niezmienionej postaci. Dzieje się tak dlatego, że katalizatory mają zdolność do obniżenia energii aktywacji reakcji chemicznej (Rys. 1). Energia ta to najmniejsza ilość energii, jaką trzeba dostarczyć by reakcja się rozpoczęła. Na przedstawionym wykresie możemy zauważyć, że energia aktywacji reakcji niekatalizowanej Ea1 jest rzeczywiście wyższa niż reakcji katalizowanej Ea2. Zauważmy też, że sumaryczna różnica energii wewnętrznej między substratami a produktami ΔE nie ulega zmianie przy zastosowaniu katalizatora.
Organizmy żywe wykorzystują bardzo wiele różnych enzymów. Ich działanie jest bardzo specyficzne, enzym zwykle katalizuje jedną lub co najwyżej kilka reakcji. Bez nich zjawisko zwane życiem byłoby niemożliwe.
Spróbujemy wykryć jeden z nich. Stosunkowo łatwo możemy wykazać działanie ptialiny czyli amylazy ślinowej. Jej aktywność katalityczna powoduje rozbicie cząstki skomplikowanego wielocukru jakim jest skrobia. Naturalna skrobia jest w istocie mieszaniną dwóch związków, amylozy i amylopektyny [1].
Skrobia jest najważniejszym polisacharydem zapasowym u roślin, które magazynują go w owocach, nasionach, korzeniach w formie ziaren w liściach, bulwach, rdzeniu łodygi i kłączach. Szczególnie bogate w skrobię są ziarna zbóż i bulwy ziemniaka (Fot.1). Jest ona dobrym składnikiem odżywczym i głównym węglowodanem w diecie człowieka [2].
Organizm człowieka nie może jednak bezpośrednio wykorzystywać skrobi. W jaki więc sposób pobieramy ją z pokarmu? Odgrywa tutaj niebagatelną rolę amylaza: katalizuje ona reakcję rozkładu skrobi na maltozę i dekstrynę. Te prostsze cukry są dalej rozkładane aż do glukozy, która może być już wchłonięta do krwioobiegu. Pierwszy kontakt amylazy ze spożywaną skrobią zachodzi już w jamie ustnej, ponieważ enzym ten jako ptialina jest zawarta w ślinie. W tym doświadczeniu dowiedziemy, że rzeczywiście amylaza występuje w ślinie i rozkłada skrobię.
Przygotowanie
Jako źródło skrobi wykorzystamy mąkę ziemniaczaną. Nie rozpuszcza się ona niestety w wodzie na zimno. Musimy postąpić nieco inaczej. Należy wsypać niewielką ilość (szczyptę) mąki ziemniaczanej do około szklanki wody. Następnie ciągle mieszając podgrzewać powoli na kuchence aż do temperatury wrzenia. Powinniśmy zauważyć zgęstnienie mieszaniny. Po ochłodzeniu powinien powstać gęstszy lub rzadszy krochmal (kisiel). Ma on jednak zbyt duże stężenie skrobi jak na nasze potrzeby. Do szklanki zimnej wody dodajemy więc jedynie jedną lub dwie łyżki poprzednio przygotowanego krochmalu i mieszamy. Otrzymany roztwór skrobi jest gotowy do doświadczenia. Nalewany równą ilość roztworu do dwóch probówek. Jedną pozostawiamy bez zmian, zaś do drugiej dodajemy niewielką ilość (parę kropli) śliny (Fot.2).
Probówki powinny teraz być przechowywane z ciepłym miejscu. Temperatura zbliżona do temperatury ciała wpływa korzystnie na szybkość zachodzącej reakcji, nie można jednak stosować dużo wyższych temperatur. Pamiętajmy, że zawarta w ślinie amylaza jest białkiem, więc w wyższej temperaturze się po prostu ścina (ulega denaturacji) i przestaje wykazywać swoje właściwości katalityczne. Probówki można zanurzyć na czas inkubacji w letniej wodzie.
Analiza
Po dwóch godzinach przystępujemy do analizy. W celu wykrycia skrobi zastosujemy kupioną w aptece jodynę. Jest to alkoholowy roztwór jodu, który ma tę właściwość, że wiąże się z cząsteczkami skrobi nadając jej fioletową lub niebieską barwę (w mniejszym stężeniu).
Chociaż występująca w doświadczeniu jodyna nie jest silną trucizną to należy zachować środki ostrożności jak zawsze przy pracy z chemikaliami. Jodyna może powodować silną reakcję uczuleniową u niektórych osób. Należy także uważać, ponieważ nierozcieńczony roztwór jodu pozostawia na skórze trudne do usunięcia plamy.
Chcąc przekonać się o właściwościach katalitycznych amylazy ślinowej dodajemy do każdej z probówek po parę kropel jodyny. Zawartość jednej z probówek ulega wybarwieniu, zaś barwa drugiej pozostaje bez zmian (Fot.3).
Zwróćmy uwagę, że wybarwieniu uległa jedynie zawartość probówki, która nie zawierała amylazy ślinowej. W probówce, która zawierała dodatkowo ten enzym nie zaobserwowano żadnej barwy.
Wyjaśnienie
Brak barwy w jednej z probówek świadczy, że nie ma już w niej skrobi. Została ona rozłożona przez zawartą w ślinie amylazę. Enzym ten niszczy wiązania między monomerami skrobi, którymi są cząsteczki glukozy. W wyniku tego powstają prostsze węglowodany, takie jak maltoza i dekstryna. Są one niewykrywalne za pomocą jodyny - stąd brak barwy w probówce, w której dzięki amylazie zaszedł całkowity rozkład skrobi ziemniaczanej [3].
Literatura:
- [1] Leuchs E. F., Wirkung des Speichels auf Stärke, Annalen der Physik, vol. 98, no. 8, 1831, str. 623 powrót
- [2] Perry G. H., Dominy N. J., Claw K. G., Lee A. S., Fiegler H., Redon R., Werner J., Villanea F. A., Mountain J. L., Misra R., Carter N. P., Lee C., Stone A. C., Diet and the evolution of human amylase gene copy number variation, Nature genetics, 39 (10), 2007, str. 1256-1260 powrót
- [3] Rodwell V. W., Kennelly P. J., Rozdział: Enzymy - właściwości ogólne, w: Murray R. K., Kokot F., Koj A., Aleksandrowicz Z., Biochemia Harpera, Wydawnictwo Lekarskie PZWL, Warszawa, 2006, str. 99-113 powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples


