Nieco inne wskaźniki
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (2/2022):

Każda dziedzina nauki – nawet najtrudniejsza do zrozumienia dla szarego człowieka lub bardzo hermetyczna – posiada w zakresie wykorzystywanych przez nią pojęć czy metod takie, które z jakichś powodów zdołały w mniejszym lub większym stopniu przeniknąć do powszechnej świadomości, czyli do umysłów ludzi niekoniecznie związanych z tym tematem. Ma to często związek z będącymi udziałem prawie nas wszystkich przeżyciami szkolnymi. W przypadku matematyki będą to na przykład trudności w posługiwaniu się trygonometrią lub równaniami kwadratowymi, jeśli chodzi o matematykę to często można usłyszeć choćby o zasadach dynamiki Newtona. Co moglibyśmy wskazać, poza wykonywaniem ciekawych doświadczeń (a częściej ich brakiem), w zakresie chemii? Myślę, że jednym z takich tematów będzie odczyn środowiska czy raczej jedna z jego skal (pH), obecna nawet z reklamach telewizyjnych, a często bardzo słabo rozumiana.
Skala pH jest ilościową skalą kwasowości i zasadowości wodnych roztworów związków chemicznych. Jest oparta na aktywności jonów wodorowych H+ w roztworach wodnych. Czysto formalnie pH definiuje się jako ujemny logarytm dziesiętny aktywności kationów wodorowych aH+, co możemy zapisać jako
Pojęcie pH wprowadził do chemii duński biochemik Søren Sørensen w 1909 roku. Oryginalnie pH zostało zdefiniowane jako ujemny logarytm stężenia jonów wodorowych [1].
W czystej wodzie H2O cząsteczki ulegają autodysocjacji, co prowadzi do powstawania jonów H3O+ i OH-:
Reakcja ta jest, jak widać, odwracalna; jej równowaga jest silnie przesunięta w lewo, czyli w stronę tworzenia cząsteczki wody. Stężenie jonów H3O+ w czystej wodzie w temp. 25°C wynosi 10−7 mol/dm3, a jej pH jest równe 7 (–log1010−7). Ponieważ w czystej wodzie stężenie jonów wodorowych i wodorotlenowych jest takie samo, ma ona odczyn obojętny (pH=7). W roztworach o pH niższym niż 7 stężenie jonów wodorowych jest większe niż wodorotlenowych i roztwory takie mają odczyn kwasowy, natomiast w roztworach o pH wyższym od 7 większe jest stężenie jonów wodorotlenowych, więc roztwory takie mają odczyn zasadowy.
Dziś już dosyć powszechnie wykorzystywaną, a jednocześnie dokładną metodą pomiarów pH jest metoda potencjometryczna, którą nazywa się pH-metrią. Wykorzystuje się w niej fakt, że zgodnie z teorią sformułowaną przez Nernsta, siła elektromotoryczna ogniwa o elektrodach identycznych, ale umieszczonych w roztworach o różnych stężeniach jonów hydroniowych, jest proporcjonalna do logarytmu stosunku tych stężeń. Dzięki temu zanurzając jedną elektrodę w roztworze o znanym pH, a drugą w próbce, można na podstawie pomiaru siły elektromotorycznej tak utworzonego ogniwa dokładnie ustalić pH próbki.
W praktyce szkolnej lub w prostszych i nie wymagających szczególnej dokładności pracach w laboratorium zamiast pH-metrii wykorzystuje się wskaźniki kwasowo-zasadowe. W ten sposób określa się substancje (lub ich mieszaniny) zmieniające swoją barwę pod wpływem odczynu środowiska. Do substancji takich zaliczamy choćby fenoloftaleinę C20H14O4 (bezbarwna w środowisku obojętnym lub umiarkowanie kwasowym, malinowa w zasadowym), błękit tymolowy C27H30O5S (czerwony w środowisku kwaśnym, żółty w obojętnym, niebieski w zasadowym) i inne.
Poza wspomnianymi syntetycznymi wskaźnikami kwasowo-zasadowymi możemy też wymienić wiele naturalnych, jak choćby wyciąg z liści czerwonej odmiany kapusty warzywnej głowiastej Brassica oleracea, soku z owoców borówki czarnej Vaccinium myrtillus lub naparu herbacianego.
Dziś chciałbym przedstawić kilka innych, dużo słabiej znanych i rzadziej wykorzystywanych naturalnych wskaźników odczynu środowiska.
Doświadczenie
Pierwszą substancją jaką się zajmiemy będzie lakmus. W tym miejscu zapewne Szanowny Czytelnik się zdziwi, dlaczego wymieniam ten wskaźnik jako rzadko wykorzystywany. Przecież lakmus i papierek lakmusowy są wręcz pierwszym, co przychodzi do głowy laikowi, gdy mówi się o substancjach zmieniających barwę z zależności od odczynu środowiska.
Jest to jednak zaszłość historyczna, ponieważ w dzisiejszych czasach wykorzystanie w roli wskaźnika naturalnego lakmusu czy jego pochodnych ma rolę raczej marginalną. Często można jednak zauważyć pewne uogólnianie – zdarza się, że dowolny wskaźnik lub papierek wskaźnikowy nasączony syntetycznymi związkami chemicznymi niewiele mającymi wspólnego ze wspomnianą substancją są nazywane lakmusowymi. Jest ro wyraźny błąd, a większość z nas – nawet chemików – nie miała nigdy okazji widzieć lub wykorzystywać naturalnego lakmusu. Inną sprawą jest to, że współczesne syntetyczne wskaźniki często odznaczają się większą czułością i trwałością niż lakmus.
Naturalny lakmus jest produktem naturalnym występującym w wielu gatunkach porostów Lichenes. Typowym przykładem jest tu Roccella fuciformis, występuja u wybrzeży Morza Śródziemnego i Atlantyku [2].
Lakmus nie jest pojedynczym związkiem chemicznym, lecz raczej mieszaniną rozpuszczalnych w wodzie barwników. W formie stałej ma postac granatowofioletowych grudek (Fot. 1).
Lakmus stosunkowo opornie rozpuszcza się w wodzie, ale wystarczy niewielka grudka do przygotowania kilkudziesięciu mililitrów wskaźnika. W roztworach o odczynie kwasowym przyjmuje barwę czerwoną, zaś w roztworach o odczynie obojętnym i zasadowym – niebieską (Fot.2).

Zakres zmiany barwy wodnego roztworu lakmusu wynosi w przybliżeniu 5-8pH. Składniki odpowiedzialne za zmiany barwy lakmusu zawierają chromofor 7-hydroksyfenoksazonowy (Rys.1).
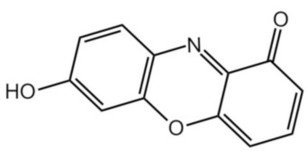
Chromoforem nazywamy z kolei rejon cząsteczki, w którym energia potrzebna do przeniesienia elektronu między orbitalami jest w zakresie światła widzialnego. Światło o określonych długościach fali, a więc też i barwie, padające na chromofor jest absorbowane, co przenosi elektrony z ich stanu podstawowego do stanu wzbudzonego. Światło odbite jest więc zubożone o pewne barwy, co powoduje powstanie wrażenia koloru. Nie dziwi więc też fakt, że zmiany strukturalne w obrębie chromoforu (i nie tylko) mogą wpływać na zmianę barwy całej cząsteczki.
Mając na uwadze, że organizmy, z których wytwarza się lakmus nie wszędzie są dostępne, chciałbym opowiedzieć także o innej substancji wskaźnikowej, jaką można pozyskać z porostów występujących na obszarze całego naszego kraju.
Parietyna C16H12O5 to związek, budowa cząsteczki którego jest oparta na szkielecie antrachinonu C14H8O2. Strukturę parietyny opisuje Rys.2.
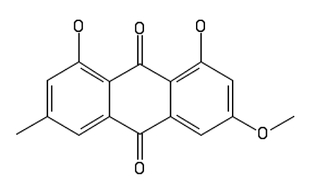
W warunkach normalnych parietyna jest pomarańczowożółtym ciałem stałym. Jest obecna w tkankach niektórych roślin, np. w rabarbarze kędzierzawym Rheum rhabarbarum i szczawiu kędzierzawym Rumex crispus. Większe jej ilości wytwarzają jednak pewne porosty.
Parietyna występuje szczególnie często u porostów z rodziny złotorostowatych Teloschistaceae. Jest dominującym barwnikiem plechy jaskrawców Caloplaca. Jako jeden z ważniejszych związków nadających barwę występuje u złotorostów Xanthoria, na których się skupimy.
Dosyć łatwym do znalezienia przedstawicielem interesujących nas porostów jest złotorost ścienny Xanthoria parietina lub złotorost pyszny Xanthoria elegans. W Polsce są one pospolite na terenie całego kraju - ten drugi występuje jednak częściej w górach i na wyżynach. Są też kosmopolityczne - żyją na wszystkich kontynentach poza Antarktydą. Bytują na korze drzew oraz krzewów, na skałach wapiennych, a nawet betonie [3]. Na betonowym płocie otaczającym mój ogród można znaleźć wiele okazów złotorostu należącego do jednego ze wspomnianych gatunków (Fot.3).
Ciało tego porostu ma postać listkowatej lub nieregularnej plechy. W jej strukturze – obok komponentu grzybowego - występują liczne glony z gatunków Trebouxia arboricola i Trebouxia irregularis. Plecha osiąga szerokość najczęściej 2-10cm i jest przy tym jest głęboko wcinana. Ściśle przylega do podłoża, chociaż można zauważyć, że brzegi delikatnie się wznoszą.
Do doświadczeń wystarczy naprawdę niewielka ilość plechy – nie należy nigdy niszczyć całego organizmu, ponieważ wzrost porostów jest powolny. Parietynę można wyekstrahować z porostów na różne sposoby, jednak najprostszym jest silne ucieranie - pomaga niewielki dodatek piasku kwarcowego - niewielkiej ilości plechy złotorostu (dosłownie kilka cm2, Fot.4) z kilkunastoma mililitrami alkoholu etylowego C2H5OH lub izopropylowego C3H7OH.
Po utarciu alkohol zabarwia się na kolor żółty, z delikatnym zielonym odcieniem pochodzącym najprawdopodobniej od niewielkich ilości chlorofilu (Fot.5).
Uzyskany macerat należy przenieść na sączek i zebrać klarowny przesącz zawierający parietynę (Fot.6). W środowisku zasadowym lub obojętnym barwa roztworu jest żółta, zaś po zakwaszeniu zmienia się na czerwoną.
Co ciekawe, parietyna dodatkowo jest także fluorescencyjnym wskaźnikiem kwasowo-zasadowym [4]. Można się o tym łatwo przekonać oświetlając próbkę roztworu lampą UV lub laserem półprzewodnikowym o niebieskiej (raczej fioletowej) barwie światła (Fot.7).
W środowisku zasadowym i obojętnym parietyna wykazuje bardzo silną żółtą fluorescencję po wzbudzeniu światłem fioletowym lub ultrafioletowym – objawia się to jako świecąca smuga na drodze światła z lasera (Fot.7A). Po zakwaszeniu fluorescencja słabnie i zmienia kolor na różowy. W rzeczywistości żółta fluorescencja parietyny właściwie wtedy zanika i staje się zauważalna słabsza fluorescencja niewielkich ilości chlorofilu (Fot.7B).
Zostawmy teraz porosty i skierujmy swoje zainteresowanie na królestwo roślin Plantae. Klitoria Clitoria to rodzaj roślin z rodziny bobowatych Fabacae. Obejmuje co najmniej kilkadziesiąt gatunków, występujących dziko w strefie tropikalnej i subtropikalnej [5], z kilkoma przedstawicielami sięgającymi swym zasięgiem do strefy klimatu umiarkowanego.
Interesującą sprawą jest nazwa rodzajowa omawianych roślin. Charakterystyczny wygląd kwiatów, podobnych - nawet bez zbytniego angażowania wyobraźni - do kobiecych zewnętrznych narządów płciowych, był powodem nadania rodzajowi nazwy naukowej pochodzącej od łacińskiej nazwy łechtaczki clitoris. Warto zauważyć, że także wiele nazw ludowych tych kwiatów w różnych językach ma podobne odniesienia. Pierwsza nazwa botaniczna została zaproponowana przez pochodzącego z Gdańska przyrodnika Johanna Philippa Breyna w 1678 jako flos clitoridis ternatensibus. Miano Clitoria zostało ustalone przez Karola Linneusza w 1753. Co ciekawe, z powodów obyczajowych kilkakrotnie postulowano zmianę tej nazwy, np. na Vexillaria Eaton i Nauchea Descourtilz (obie propozycje zostały dokonane w pierwszej połowie XIX wieku), jednak nie spotkało się to z akceptacją [6].
Z naszego punktu widzenia najbardziej przydatnym i łatwo dostępnym surowcem będą suszone kwiaty klitorii ternateńskiej Clitoria ternatea, których płatki mają piękną niebieską barwę (Fot.8).
Ten gatunek klitorii znalazł zastosowanie w przemyśle spożywczym, jako naturalny i bezpieczny barwnik do żywności. Dodając suszone płatki kwiatów klitorii do naparu możemy uzyskać smaczną herbatę o intrygującym kolorze.
Chcąc zbadać przydatne właściwości wskaźnikowe barwników klitorii musimy przygotować wodny wyciąg z jej kwiatów. Jest to mało skomplikowana czynność – wystarczy wrzucić kilka suszonych kwiatów do lekko ogrzanej wody, która już po chwili intensywnie się zabarwi (Fot.9).
Po odsączeniu kwiatów możemy wypróbować właściwości naparu. Otóż okazuje się, że zmiany barwy są w tym przypadku szczególnie widowiskowe: w środowisku obojętnym ciecz jest intensywnie niebieska (Fot.10A), po zakwaszeniu staje się różowoczerwona (Fot.10B), a po zmianie odczynu na zasadowy zielona (Fot.10). Zmiany barwy są odwracalne – o ile nie zastosujemy zbyt stężonych kwasów lub zasad, które mogą doprowadzić do degradacji samego barwnika.

Myślę, że przedstawione doświadczenia i obserwacje mogą posłużyć jako argument, że zawsze warto rozglądać się za nowymi rozwiązaniami. Mogą one urozmaicić proces dydaktyczny, a w efekcie ułatwić zainteresowanie naszych słuchaczy, co jest dla nich początkiem zrozumienia tematu.
Epilog
Pisząc ten artykuł chciałem zwrócić uwagę Czytelnika, że nawet przy bardzo skromnych środkach – kosztem niewiele większym niż poświęcenie chwili czasu na rozejrzenie się wokół i zastanowienie – można zdobyć materiały dające możliwość przeprowadzenia wielu interesujących doświadczeń. Przyznam, że dla mnie osobiście właśnie tego rodzaju doświadczenia i ich efekt dydaktyczny są źródłem największej satysfakcji.
Zachęcam Czytelnika, by przeprowadził własne doświadczenia i w razie potrzeby odpowiednio je zmodyfikował według swoich pomysłów.
Literatura:
- [1] Sörensen S. P. L., Über die Messung und die Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen, Biochemische Zeitschrift, 21, 1909, str. 131-200 powrót
- [2] Hassa R., Mrzigod J., Podręczny słownik chemiczny (wyd. I), Videograf II, Katowice, 2004, str. 221 powrót
- [3] Wójciak H., Porosty, mszaki, paprotniki, Multico Oficyna Wydawnicza, Warszawa, 2010 powrót
- [4] Ples M., Światło zimne z natury - berberyna i parietyna, Biologia w Szkole, 4 (2018), Forum Media Polska Sp. z o.o., str. 59-63 powrót
- [5] Sinha K., Das P., Datta S., Natural Blue Dye from Clitoria Ternatea: Extraction and Analysis Methods, Research Journal of Textile & Apparel, 16(2), 2012, str. 34 powrót
- [6] Fantz P. R., Nomenclatural Notes on the Genus Clitoria for the Flora North American Project, Castanea, 65(2), 2000, str. 89-92 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples









