Światło z retorty
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (5/2014):

No… może niekoniecznie z retorty, ale w każdym razie w laboratorium. Chemiluminescencją nazywamy zjawisko emisji promieniowania świetlnego wytworzonego w wyniku specyficznych reakcji chemicznych. Chemiluminescencję wykazuje wiele substancji w toku odpowiednich reakcji, zwykle utleniania: lucyferyna w obecności enzymu lucyferazy, luminol, układ pirogalol-formaldehyd, biały fosfor, a nawet metaliczny sód [1]. Zjawisko to można zaobserwować także w odniesieniu do singletowej odmiany tlenu.
Tlen jest gazem występującym w postaci dwuatomowych cząsteczek. Dla tlenu O2 stanem podstawowym jest forma trypletowa (oznaczana jako 3O2) o dwóch niesparowanych elektronach w cząsteczce, będąca więc rodnikiem (Rys.1A). Natomiast wzbudzona cząsteczka ze wszystkimi sparowanymi elektronami występuje w stanie singletowym 1O2. Istnieją dwie odmiany stanu singletowego tlenu, różniące się sposobem rozmieszczenia elektronów na orbitalach molekularnych π*2p:
- Dwa sparowane elektrony na jednym orbitalu π*2p (Rys.1B),
- Dwa elektrony o przeciwnych spinach, po jednym na każdym z orbitali π*2p (Rys.1C).
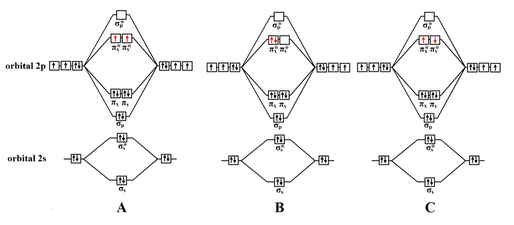
W przypadku tlenu zachodzi nietypowa sytuacja - tlen trypletowy 3O2 (będący rodnikiem) występuje w stanie podstawowym, zaś singletowy o całkowicie sparowanych elektronach odpowiada stanom wzbudzonym o wyższej energii.
Jak można się domyślać, singletowa forma tlenu jest nietrwała i może spontanicznie przejść w trypletową. Zgodnie z zasadą zachowania energii, jej nadmiar może zostać uwolniony, na przykład podczas reakcji utleniania lub w formie emisji promieniowania elektromagnetycznego z zakresu światła widzialnego (lub zbliżonego).
W przypadku izolowanej cząsteczki tlenu jej przejście ze stanu trypletowego do singletowego jest jednak ściśle zabronione przez reguły wyboru, określające warunki oddziaływania z promieniowaniem elektromagnetycznym. Czyni to takie przejście wysoce nieprawdopodobnym. Wykorzystanie sensybilizatorów (głównie barwników organicznych, np. błękitu metylenowego lub porfiryn) umożliwia jednak taki proces [2].
Tlen singletowy można też wytwarzać w sposób typowo chemiczny, np. przepuszczając strumień chloru przez alkaliczny, schłodzony 30% roztwór nadtlenku wodoru (Fot.1). Metoda ta, chociaż najczęściej proponowana, ma z punktu widzenia dydaktyki poważną wadę. Jest nią konieczność operowania gazowym chlorem, który jak wiadomo jest silnie toksyczny, a przechowywanie go może nastręczać poważnych trudności [3].
Dlatego pragnę zaproponować Czytelnikowi inną, łatwiejszą i bezpieczniejszą metodę wytwarzania tlenu singletowego i obserwowania jego chemiluminescencji. W tym celu będą potrzebne jedynie dwie, stosunkowo łatwo dostępne substancje:
- nadtlenek wodoru H2O2 30% (perhydrol),
- dichloroizocyjanuran sodu C3N3O3Cl2Na.
Dichloroizocyjanuran sodu jest wykorzystywany jako środek odkażający do zastosowań sanitarnych. Handlowy produkt, występujący najczęściej w postaci tabletek (Fot. 2), zawiera zwykle przynajmniej 80% dichloroizocyjanuranu i doskonale nadaje się do przeprowadzenia doświadczenia.
Nie wolno zapominać o zagrożeniach! Perhydrol jest żrący i w zetknięciu ze skórą wywołuje zmiany martwicze. Należy bezwzględnie unikać zanieczyszczenia oczu lub skóry! Konieczne jest stosowanie rękawic i okularów ochronnych! Dichloroizocyjanuran sodu jest szkodliwy, a w kontakcie z wodą i kwasami uwalnia toksyczne gazy. W czasie reakcji wywiązuje się chlor, który jest silnie trujący - prace trzeba prowadzić pod wyciągiem lub na zewnątrz!
Przeprowadzenie doświadczenia jest proste. Na dno zlewki o pojemności 100-200 cm3 należy wlać około 30 cm3 perhydrolu. Następnie trzeba zaciemnić pomieszczenie i dodać dichloroizocyjanuran sodu, w postaci proszku lub tabletki. W czasie gwałtownej reakcji uwalnia się duża ilość gazów, a mieszanina pieni się. Jednocześnie dochodzi do chemiluminescencji: można zauważyć światło o pięknej, jasnoczerwonej barwie (Fot.3).
Wyjaśnienie
Początkowo dochodzi do reakcji wody z anionem dichloroizocyjanuranowym:
W efekcie powstają kationy wodorowe i aniony: cyjanuranowy i chloranowy(I) [4]. Ten ostatni reaguje dalej z nadtlenkiem wodoru:
Powstały anion nadtlenochlorowy jest nietrwały i rozpada się na tlen oraz anion chlorkowy:
Powstały tlen występuje początkowo w stanie singletowym. Podczas jego przekształcenia do formy trypletowej jako podstawowej, różnica energii musi być oddana do środowiska zgodnie z zasadą zachowania energii, na przykład w postaci promieniowania. Różnica energii między stanem podstawowym, a singletowym o dwóch sparowanych elektronach obsadzonych na jednym orbitalu π*2p wynosi 94,3kJ/mol, co odpowiada energii fali świetlnej o długości około 1270nm, to jest bliskiej podczerwieni. Taka chemiluminescencja nie byłaby oczywiście dostrzegalna gołym okiem, ponieważ emitowane światło leży poza zakresem światła widzialnego.
W przypadku występowania wysokiej koncentracji tlenu singletowego dochodzi również do emisji promieniowania o długości 634nm (światło czerwone). Dzieje się tak w momentach zderzenia dwóch cząsteczek 1O2. Właśnie to zjawisko obserwujemy w przedstawionym doświadczeniu.
Reakcję tę można schematycznie przedstawić zgodnie z ogólnym mechanizmem reakcji chemiluminescencji, przedstawionym poniżej.
W wyniku reakcji substratu (lub substratów) X powstaje produkt przejściowy [Y]* występujący w stanie wzbudzonym. Wzbudzenie jest stanem o wysokiej energii, a przez to nietrwałym. Produkt przejściowy przekształca się więc spontanicznie w produkt ostateczny Y, o niższej energii. Nadwyżka energii przekształca się w energię promienistą hν. Substratowi X, produktowi przejściowemu [Y]* i produktowi ostatecznemu Y odpowiadają więc tutaj, kolejno: anion nadtlenochlorowy ClOO-, tlen singletowy 1O2 oraz tlen trypletowy 3O2.
Literatura:
- [1] Ples M., Chemiluminescencja metalicznego sodu, Chemia w Szkole, 2014, 1, str. 5-7 powrót
- [2] Laingl M., The Three Forms of Molecular Oxygen, Journal of Chemical Education, 1989, 66 (6), str. 453-455 powrót
- [3] Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, 2001, str. 161-163 powrót
- [4] Pinto G., Rohrig B., Use of chloroisocyanurates for disinfection of water, Journal of Chemical Education, 2003, 80(1): str. 41–44 powrót
Życzę miłej i pouczającej zabawy:)
Uzupełnienie autora
Efekt uzyskany w doświadczeniu można zobaczyć też na poniższym filmie:
Marek Ples


