Ab ovo
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (6/2014):

Fluorescencja porfiryn wyizolowanych ze skorupy jaja kurzego
Wyrażenie ab ovo pochodzi z łaciny i dosłownie znaczy „od jaja”, co przez wielu jest uważane za skrót łacińskiego przysłowia ab ovo ad mala („od jaja do jabłka”), które opisywało rzymską ucztę, tradycyjnie rozpoczynającą się właśnie spożyciem jaj. Zwrot ten jest powszechnie używany w znaczeniu „od początku” [3]. Co ma jednak wspólnego kurze jajo z chemią?
Otóż w skorupie jaj, szczególnie tych z rodzaju brązowych, znajduje się znacząca ilość związków z grupy porfiryn. Z chemicznego punktu widzenia są one pochodnymi porfiny, której cząsteczka składa się z czterech pięcioczłonowych, heterocyklicznych pierścieni pirolowych, połączonych ze sobą mostkami metinowymi (Rys.1) [1].
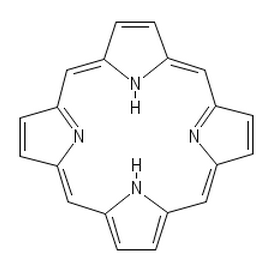
Szkielet porfirynowy jest obecny w strukturze wielu związków pełniących ważne funkcje biologiczne. Występuje choćby w cząsteczce hemu (jako kompleks z żelazem), będącego grupą prostetyczną m.in. hemoglobiny, mioglobiny, czy cytochromów, a także w cząsteczkach chlorofili (jako kompleks z magnezem).
Pochodne porfiryny w odpowiednich warunkach wykazują często dosyć silną fluorescencję. W prezentowanym doświadczeniu opiszę w jaki sposób, z wykorzystaniem prostych środków wyizolować te związki z powszechnie dostępnego materiału, jakim są skorupy jaj kurzych.
Doświadczenie
Wielką zaletą proponowanego doświadczenia jest to, że można je przeprowadzić z wykorzystaniem łatwych do zdobycia i stosunkowo mało niebezpiecznych substancji [2]. Podstawowym surowcem są tu skorupy jaj, w szczególności te o brązowej barwie (Fot. 1). Jaja o białej skorupce się nie nadają, ponieważ zawiera ona znacząco mniej interesujących nas związków chemicznych.
Po rozbiciu jaja skorupę należy umyć w ciepłej wodzie, tak aby oczyścić ją z pozostałości białka, a następnie wysuszyć.
W celu wyizolowania porfiryn zawartych w skorupie, musimy mieć do dyspozycji:
- kwas chlorowodorowy HCl (Cp = 15%) lub kwas octowy CH3COOH (jako ocet spożywczy, Cp = 10%),
- octan etylu CH3COOC2H5.
Najlepsze wyniki zapewnia zastosowanie kwasu chlorowodorowego HCl, można go jednak zastąpić octem spożywczym, czyli roztworem kwasu octowego CH3COOH o stężeniu dochodzącym do 10%. Octan etylu najlepiej wykorzystać czysty chemicznie. Wchodzi on jednak w skład wielu zmywaczy lakieru do paznokci, więc próby ich wykorzystania mogą stanowić dodatkowe pole do eksperymentów.
Przygotowanie doświadczenia nie nastręcza trudności. Oczyszczoną skorupę jaja należy pokruszyć na niewielkie fragmenty, które trzeba zalać 2 cm3 roztworu kwasu chlorowodorowego HCl lub podobną ilością kwasu octowego CH3COOH.
Natychmiast zaczyna zachodzić reakcja kwasu z węglanem wapnia CaCO3 zawartym w skorupie, zgodnie z reakcją opisaną równaniem:
przy czym wytwarzanie dużych ilości gazowego dwutlenku węgla CO2 wywołuje pienienie się mieszaniny. Podczas roztwarzania węglanu wapnia CaCO3 zostają także uwolnione porfiryny, wcześniej uwięzione w strukturze skorupy – można więc dokonać ich ekstrakcji. Do pieniącej się mieszaniny dodajemy 5-7cm3 octanu etylu CH3COOC2H5, całość wytrząsamy i pozostawiamy na pewien czas (Fot. 2). O ile w przypadku kwasu chlorowodorowego wystarczy kilkanaście minut, to wykorzystanie kwasu octowego wymaga pozostawienia mieszaniny na czas do kilku godzin.
Po upływie wspomnianego wyżej czasu wytrząsamy mieszaninę raz jeszcze, odsączamy stałe pozostałości, a ciecz wlewamy do cylindra miarowego. Dosyć szybko dochodzi do rozdzielenia faz: u dołu znajduje się faza wodna, zaś u góry faza rozpuszczalnika organicznego, zawierająca wyekstrahowane porfiryny (Fot. 3A). Obie warstwy nie wykazują widocznego zabarwienia.
Obraz zmienia się jednak radykalnie, kiedy próbkę oświetlimy światłem ultrafioletowym (o długości fali λ=366nm). Faza górna (organiczna), dzięki rozpuszczonym w niej porfirynom wykazuje wyraźnie widoczną jasnoczerwoną fluorescencję (Fot. 3B). Warto zwrócić uwagę na to, że dolna faza wodna nie wykazuje żadnej widocznej fluorescencji.
Wyjaśnienie
Skorupa jaja kurzego zawiera wiele pochodnych porfiryn, między innymi protoporfirynę IX, koproporfirynę, uroporfirynę i inne. W skorupie brązowych jaj kurzych w największej ilości występuje protoporfiryna IX, nazywana także ooporfiryną (Rys. 2), która nadaje im charakterystyczną barwę [5].
Protoporfiryna IX jest jednym z prekursorów wspomnianych uprzednio ważnych biologicznie związków (hem, chlorofile, cytochromy). Nie dziwi więc to, że sekwencja procesów chemicznych prowadzących do jej syntezy jest w dużym stopniu zachowywana w toku rozwoju życia na Ziemi – nie występują tu znaczące różnice nawet między tak odległymi ewolucyjnie organizmami jak bakterie i ssaki [4].
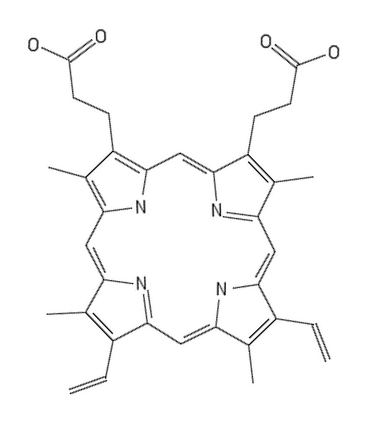
Roztwór protoporfiryny IX w rozpuszczalniku organicznym, podobnie jak i innych pochodnych porfiny (np. chlorofilu), wykazuje silną fluorescencję o barwie czerwonej przy oświetleniu światłem ultrafioletowym.
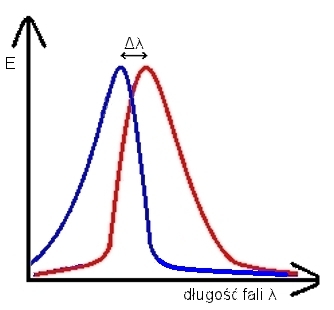
Można tu zaobserwować zjawisko przesunięcia Stokesa. Polega ono na przesunięciu maksimum widma emisji w stosunku do maksimum widma absorpcji dla określonego stanu wzbudzonego. Przy przesunięciu Stokesa maksimum emisji przypada na zakres większej długości fali λ niż absorpcja (Rys. 3).
Łatwo to wyjaśnić przy wykorzystaniu uproszczonego diagramu Jabłońskiego (Rys. 4).
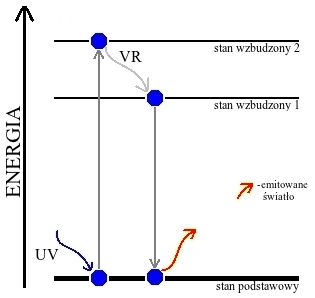
Cząsteczka w stanie podstawowym, czyli o najniższej energii, może pochłonąć określoną porcję energii (w tym przypadku w postaci promieniowania ultrafioletowego), a tym samym przejść na jeden ze stanów wzbudzonych, o wyższej energii. Część energii zostaje jednak szybko rozproszona na skutek przejść bezpromienistych, na przykład między stanami oscylacyjnymi, na skutek czego cząsteczka przechodzi na niższy stan wzbudzony. Oczywiście sytuacja taka jest nietrwała – cząsteczka szybko więc wraca do stanu podstawowego, oddając pozostałą energię w postaci promieniowania. Promieniowanie wyemitowane ma więc niższą energię niż pochłonięte, co objawia się zwiększeniem długości fali λ.
Literatura:
- [1] Bojarski J., Chemia organiczna, Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków 1999 powrót
- [2] Brandl H., Weiß D., Experimente mit Pflanzeninhaltsstoffen - Fluoreszenzfarbstoffe in der Natur, Chemie in unserer Zeit, 2013, 47, str. 122-131 powrót
- [3] Gloger Z., Encyklopedia staropolska, T. 1-4, Warszawa 1900-1903 powrót
- [4] Layer G., Reichelt J., Jahn D., Structure and function of enzymes in heme biosynthesis, Protein Science, 2010 powrót
- [5] With T. K., Porphyrins in egg shells, The Biochemical Journal, 1973, 137, str. 597-598 powrót
Życzę miłej i pouczającej zabawy:)
Marek Ples


