Drzewo w probówce
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (6/2021):


Pierwiastki metaliczne spotykamy w naturze przeważnie w postaci rud zawierających ich związki. Jedynie nieliczne mało reaktywne chemicznie metale występują w postaci wolnej, jako pierwiastki rodzime. Dzięki swoim specyficznym własnościom (m.in. mechanicznym) metale są powszechnie wykorzystywane do produkcji materiałów konstrukcyjnych i elementów maszyn. Ich właściwości chemiczne także są wykorzystywane w przemyśle.
Jeśli chodzi o budowę molekularną, to metale spośród pozostałych pierwiastków wyróżniają się występowaniem elektronów swobodnych w obrębie sieci krystalicznej. Obecność zdolnych do ruchu nośników ładunku jest powodem doskonałego przewodnictwa elektrycznego metali. Pierwiastki metaliczne w stałym stanie skupienia cechują się też zwykle połyskiem, ciągliwością, kowalnością oraz wysoką wartością przewodnictwa cieplnego. Z punktu widzenia chemika ważne jest też, że metale dążą przeważnie do tworzenia związków o właściwościach zasadowych i nukleofilowych, nie zaś kwasowych i elektrofilowych.
Wspomniane wyżej mało reaktywne metale zwyczajowo nazywamy szlachetnymi. Są to platynowce, do których zaliczamy platynę Pt, ruten Ru, rod Rh, pallad Pd, osm Os i iryd Ir oraz dwa pierwiastki z grupy miedziowców, a dokładnie srebro Ag i złoto Au (czasem dodatkowo także ren Re i rtęć Hg).
Metale w stanie stałym spotykamy w formie krystalicznej. Kryształy metali mogą mieć różnorodne formy. Jedną z nich są dendryty, będące charakterystycznymi agregatami drobnych kryształów. Kształtem przypominają zwykle rozgałęzione pędy roślinne.
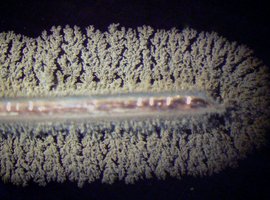
Często prowadzonym w szkolnych i uczelnianych pracowniach doświadczeniem jest hodowla dendrytycznych kryształów srebra na drodze elektrolizy. W odpowiednich warunkach na granicy faz roztwór-powietrze dochodzi do uformowania pięknych kryształów srebra o cechach fraktanych (Fot.1).
Powstałe w ten sposób kryształy z dobrym przybliżeniem są strukturami dwuwymiarowymi, co pozwala na ułatwione studiowanie podstaw ich budowy. Jeśli jednak chcemy zaobserwować rozwój kryształów srebra w trzech wymiarach, to napotykamy na pewien problem – są one tak delikatne, że podczas wzrostu w roztworze często łamią się pod własnym ciężarem. Ich obserwacja jest więc możliwa jedynie w przypadku niewielkich kryształów, które trzeba obserwować pod mikroskopem (Fot.2).
Chcąc otrzymać większe kryształy srebra o efektownej strukturze, warto skorzystać z techniki hodowli w ośrodku żelowym [1].
Doświadczenie
W celu wykonania doświadczenia potrzebujemy jedynie czterech substancji. Będą to:
- szkło wodne
- azotan(V) srebra AgNO3
- miedź Cu
- kwas octowy CH3COOH 6-10% (ocet spożywczy, spirytusowy)
Szkło wodne jest roztworem wodnym krzemianu sodu lub potasu. Spotyka się też szkło wodne będące roztworem mieszaniny krzemianów sodu i potasu. W każdym razie można je traktować jako układ o zmiennym składzie i wzorze ogólnym mMe2O•nSiO2•xH2O (Me – Na lub K; m, n, x – współczynniki o zmiennych wartościach). Szkło wodne powstaje w wyniku reakcji stopionego wodorotlenku lub węglanu sodu (lub potasu) z krzemionką SiO2 [2]. Szkło wodne znajduje wiele zastosowań, głównie jako lepiszcze odporne na wysoką temperaturę: do wyrobu klejów oraz kitów, jako spoiwo do materiałów ceramicznych, przy produkcji form w odlewnictwie, przy impregnacji materiałów ogniotrwałych. Nie jest ono silnie toksyczne, ale produkt handlowy często zawiera dodatek wodorotlenku sodu – z tego powodu może mieć właściwości żrące
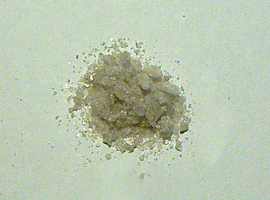
Jako źródło jonów srebra w naszym doświadczeniu zastosujemy azotan(V) srebra. Związek ten bywa do dziś nazywany lapisem, ponieważ już alchemicy ochrzcili go łacińskim terminem lapis infernalis, czyli kamieniem piekielnym. Warto się w tym miejscu zastanowić, dlaczego substancja występująca w postaci białych (na świetle ciemniejących z czasem) kryształów (Fot.3) otrzymała nazwę kojarzącą się w tak demoniczny sposób.
Jednym z powodów był z całą pewnością fakt, że w wyniku kontaktu tej soli z naszą skórą – po wystawieniu na światło – w obrębie tkanki wydziela się metaliczne srebro, co objawia się powstaniem czarnych, właściwie niemożliwych do usunięcia plam. Przebarwień tych możemy się pozbyć dopiero wraz z łuszczącym się naskórkiem, co bez zastosowania metod przyspieszających ten proces może stać się dopiero po kilku, kilkunastu dniach. Azotan(V) srebra należy traktować jako substancję toksyczną, a dodatkowo wykazującą delikatne działanie żrące na naszą skórę. Środki ochrony osobistej – fartuch, rękawiczki i okulary ochronne - są konieczne, jak zawsze zresztą przy pracy w laboratorium [3].
Czysty kwas octowy jest bezbarwną, żrącą cieczą. Łatwo miesza się z wodą paktycznie w każdym stosunku. W doświadczeniu wykorzystamy rozcieńczony roztwór kwasu nazywany octem i wykorzystywany w sztuce kulinarnej.
Ostatnią potrzebną nam substancją jest metaliczna miedź – metal o pięknej czerwonej barwie. Nam przyda się niezbyt gruby drut miedziany – ja zastosowałem wyrób o średnicy 0,4mm. Jesli stosujemy drut wykorzystywany zwykle w elektrotechnice, to trzeba go przed doświadczeniem pozbawić warstwy izolacyjnej.
Drut musimy wygiąć tak, aby możliwe było odpowiednie umieszczenie go w probówce. Można oczywiście zastosować także inne naczynie, np. zlewkę, ale probówka zapewnia najlepszą widoczność efektu, dzięki niezbyt grubej warstwie żelu krzemionkowego pomiędzy powstałymi kryształami a ścianami bocznymi naczynia. W toku doświadczeń okazało się, że doskonałym sposobem jest nawinięcie drutu np. na długopisie lub ołówku, a następnie wygięcie go w sposób pokazany na Fot.4.
Aby otrzymać żel krzemionkowy musimy na początku rozcieńczyć odpowiednio szkło wodne, tak aby jego gęstość wyniosła około 1g/cm3, a więc była zbliżona do gęstości wody. Według danych literaturowych osiąga się to poprzez zmieszanie jednej objętości handlowego szkła wodnego z ośmioma objętościami wody [4]. Do przygotowania wszystkich roztworów w doświadczeniu musimy używać koniecznie wody oczyszczonej: destylowanej lub demineralizowanej.
W probówce umieśćmy następnie odpowiednio ukształtowany drut, po czym zalejmy go mieszaniną równych objętości rozcieńczonego w powyższy sposób szkła wodnego i 6% kwasu octowego. Czas żelowania jest dosyć długi i może sięgać kilkunastu godzin – w razie niepowodzenia trzeba poeksperymentować ze stopniem rozcieńczenia szkła wodnego i stosunkiem w jakim mieszamy je następnie z kwasem octowym. Gotowy układ powinien wyglądać jak na Fot.5.
Zauważmy, że ukształtowana w sprężynę część drutu służy jako podstawa, a wystająca ku górze prosta i zaostrzona część drutu jest położona z grubsza osiowo w probówce. Warstwa żelu powinna sięgać 2-4cm ponad zakończenie drutu. Jak widzimy, żel jest prawie doskonale przezroczysty.
Aby uruchomić proces, na wierzch zestalonego żelu wkraplamy kilkucentymetrową warstwę wodnego roztworu soli srebra o stężeniu od kilku do kilkunastu procent (ja stosuję zwykle 8%) – od stężenia tego roztworu, podobnie jak i temperatury oraz właściwości żelu krzemionkowego zależy w dużej mierze uzyskany efekt. Warto przygotować warianty doświadczenia z wykorzystaniem roztworów soli o różnym stężeniu. Musimy przy tym jednak pamiętać, że zwykle im mniejsze zastosujemy stężenie, tym dłużej będziemy musieli czekać na efekt. Poza momentami obserwacji cały układ reakcyjny powinien być chroniony przed światłem, ponieważ związki srebra mogą ulegać rozkładowi pod jego wpływem.
W ciągu pierwszych godzin możemy zauważyć, że w głąb żelu od powierzchni jego kontaktu z roztworem soli srebra zaczyna się przemieszczać smuga białawej barwy (Fot.6). Jest to spowodowane faktem dyfuzji jonów, między innymi srebra Ag+ w głąb żelu, połączonej zapewne z ich reakcją ze śladami jonów chlorkowych Cl- będącymi zanieczyszczeniem szkła wodnego, co skutkuje wydzieleniem się białego, a przy tym światłoczułego osadu. Niewielka ilość chlorków powoduje jednak, że nie wszystkie jony srebra zostają wykorzystane w tej reakcji co jest sprzyjającą okolicznością, ponieważ są nam one potrzebne w innym celu.
Po pewnym czasie – liczącym zwykle od kilku do kilkunastu godzin – front migrujących w głąb żelu jonów srebrowych dotrze do zakończenia miedzianego drutu, po czym powędruje dalej. Na ostrzu drutu zacznie jednak się dziać coś ciekawego: najpierw poszarzeje, a następnie zaczną z niego wyrastać jakby kiełki, rozgałęziające się po pewnym czasie. Struktura rośnie z godziny na godzinę, sprawiając wrażenie jakby ożywionej – proces ten najlepiej śledzić przez szkło powiększające (Fot.7). Ostatnia fotografia została wykonana w 5 dni od naniesienia roztworu soli srebra.
W toku doświadczenia powstanie struktura przypominająca miniaturowe drzewko o miedzianym pniu i rozgałęzionej koronie zbudowanej z kryształów metalicznego srebra. Prezentuje się ona szczególnie pięknie w powiększeniu (Fot. 8).

Wyjaśnienie
Reakcję zachodzącą podczas żelowania zakwaszonego roztworu szkła wodnego możemy zapisać następująco:
Powstająca uwodniona krzemionka tworzy sztywny żel, w obrębie którego jednak ruchliwość jonów srebrowych zostaje zachowana.
Migrujące w głąb żelu jony srebrowe wchodzą w kontakt z metaliczną miedzią. Jak wiemy, metale bardziej aktywne chemicznie (o niższym potencjale elektrochemicznym) wypierają ze związków metale mniej aktywne (o wyższym potencjale). W przypadku srebra jego potencjał standardowy - mierzony względem elektrody wodorowej - wynosi 0,80V, zaś dla miedzi 0,34V [5]. Możemy więc zapisać zachodzącą reakcję:
Miedź ulega roztworzeniu, przechodząc w dwudodatnie kationy, natomiast srebro ulega redukcji do postaci atomowej.
Budowę drzewiastych, rozgałęzionych kryształów srebra można wyjaśnić zjawiskiem agregacji ograniczonej dyfuzją (ang. diffusion-limited aggregation) [6]. Ruchliwe jony srebra obecne w roztworze są tu redukowane na powierzchni metalu do nierozpuszczalnych, a więc unieruchomionych atomów srebra.
Analogiczne zjawiska występują także w naturze. Opisany procesy nie są jedynie laboratoryjną ciekawostką – agregaty minerału piroluzytu z racji swojej formy bywają często mylone ze skamieniałościami roślin, lecz są całkowicie abiotycznego pochodzenia.
Fakt zahamowania konwekcji w układzie, a także kontaktu przemieszczających się w żelu jonów wchodzących w kontakt z czynnikiem strącającym pozwala czasem na zaobserwowanie w układzie dodatkowego zjawiska, czyli formowania tzw. pierścieni Lieseganga. Jest to interesujący przykład samoorganizacji [7].
Literatura:
- [1] Ples M., Metaliczne rośliny. Krystaliczne dendryty srebra, Chemia w Szkole, 3 (2015), Agencja AS Józef Szewczyk, str. 6-10 powrót
- [2] Korzeniowska M., Wpływ struktury uwodnionego krzemianu sodu jako spoiwa mas formierskich na własności żelu krzemionkowego w wysokich temperaturach, dostępne online: https://winntbg.bg.agh.edu.pl/rozprawy2/10073/full10073.pdf [dostęp: 22.11.2021] powrót
- [3] Ples M., Światłoczułe związki w fotografii, Chemia w Szkole, 1 (2018), Agencja AS Józef Szewczyk, str. 35-41 powrót
- [4] Chojnacki J., Techniki krystalizacji I. Krystalizacja z żelu, dostępne online: https://chem.pg.edu.pl/documents/175187/63147198/Krystalizacja%20z%20%C5%Bcelu [dostęp: 22.11.2021] powrót
- [5] CRC Handbook of Chemistry and Physics 88th, CRC Press, 2008 powrót
- [6] Falconer K., Techniques in Fractal Geometry, John Willey and Sons, 1997 powrót
- [7] Ples M., Porządek z chaosu. O samoorganizacji i pierścieniach Lieseganga, Chemia w Szkole, 1 (2016), Agencja AS Józef Szewczyk, str. 15-19 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Wzrost kryształów srebra w opisanych warunkach jest dosyć szybki, ale mimo wszystko trwa co najmniej kilkadziesiąt godzin. Abyśmy mogli podziwiać szczegóły tego procesu wykonałem film metodą zdjęć poklatkowych - kolejne klatki filmu (jako pojedyncze fotografie) były wykonywane co około 3 minuty. Ich wyświetlenie ze standardową prędkością 25 klatek na sekundę daje w efekcie wielokrotne przyspieszenie obserwowanego procesu. Dodatkowo po wykonaniu każdej fotografii probówka była obracana o pewien niewielki kąt, dla zapewnienia widoku ze wszystkich stron.
Marek Ples