Mnóstwo piany - katalityczny rozkład nadtlenku wodoru
Dla efektu!
Perhydrol jest 30% roztworem nadtlenku wodoru w wodzie. Jest bezbarwną i bezwonną cieczą o gęstości minimalnie większej niż woda. Wykazuje silne właściwości żrące, w kontakcie ze skórą powoduje miejscowe zmiany martwicze.
Perhydrol jest stosowany jako silny środek utleniający w przemyśle chemicznym. Stosuje się go powszechnie przy produkcji wielu barwników organicznych, także przy produkcji inicjujących wybuchowych nadtlenków jak na przykład nadtlenek acetonu.
Nadtlenek wodoru jest bardzo nietrwały i w obecności pewnych katalizatorów z łatwością rozkłada się na tlen i wodę według równania:
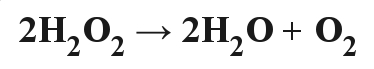
Właśnie tą reakcję wykorzystamy do wytworzenia chemicznej piany.
Do dzieła!
Wykaz potrzebnych materiałów nie jest długi:
- Perhydrol,
- Jodek potasu,
- Płyn do mycia naczyń
Ostrzeżenie: Perhydrol jest silnym utleniaczem i ma silne właściwości żrące. Należy stosować rękawiczki i okulary ochronne! Powstała piana zawiera jod - może trwale zabarwić dłonie. Należy unikać kontaktu ze skórą. Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Perhydrol należy ostrożnie wlać do naczynia o wąskiej szyjce. Następnie trzeba dodać kilka kropel płynu do mycia naczyń. Naczynie ustawiamy na gładkiej powierzchni i szybkim ruchem wsypujemy niewielką ilość jodku potasu. Rozpocznie się burzliwa reakcja, której efektem będzie wytworzenie dużej ilości gorącej piany:
Nawet z małej ilości mieszaniny powstaje spora objętość piany:
Wyjaśnienie tego faktu jest proste. Jodek potasu jest silnym katalizatorem rozkładu perhydrolu. Dzięki niemu nadtlenek wodoru rozkłada się według powyższego równania na wodę i tlen. W obecności w roztworze detergentu tlen zostaje uwięziony i powstaje piana.
Innym doświadczeniem, w trakcie którego wykorzystujemy natlenek wodoru jest gwałtowny rozkład perhydrolu.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa
- Easton M.F., Mitchell A.G., Wynne-Jones W.F.K., The behaviour of mixtures of hydrogen peroxide and water. Part 1. Determination of the densities of mixtures of hydrogen peroxide and water, Transactions of the Faraday Society, 1952, 48, str. 796
- Knözinger H., Kochloefl K., "Heterogeneous Catalysis and Solid Catalysts" w: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002
- Masel R.I., Chemical Kinetics and Catalysis, Wiley-Interscience, Nowy Jork, 2001
Marek Ples

