Metaliczne rośliny
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (3/2015):

Krystaliczne dendryty srebra
Metale odegrały bardzo ważną rolę w procesie rozwoju ludzkiej cywilizacji. Znajduje to odzwierciedlenie w podziale prehistorii na epoki. Tylko epoka kamienna jako najwcześniejsza i najdłużej trwająca opierała się na wykorzystaniu narzędzi wykonanych z różnego rodzaju kamienia. Każda kolejna epoka wiązała się już z opanowaniem metod pozyskiwania i wykorzystania metali różnego rodzaju. Były to odpowiednio epoki: miedzi, brązu i żelaza. Oczywiście, z metali nie wykonywano wyłącznie użytecznych sprzętów i narzędzi. Metale takie jak złoto czy srebro, ze względu na szczególne właściwości, piękny wygląd lub rzadkość występowania były wykorzystywane także do produkcji ozdób, czy nawet jako waluta.
Wystarczy rzut oka na układ okresowy pierwiastków, by stwierdzić, że metale stanowią zdecydowaną większość wszystkich znanych pierwiastków. Czym są jednak metale? Wśród innych substancji prostych wyróżniają się one występowaniem elektronów swobodnych w obrębie sieci krystalicznej. Obecność swobodnych elektronów, jako zdolnych do ruchu nośników ładunku elektrycznego, jest powodem bardzo dobrego przewodnictwa elektrycznego metali. Pierwiastki metaliczne w stałym stanie skupienia cechują się też zwykle połyskiem, ciągliwością, kowalnością oraz dobrym przewodnictwem cieplnym. Z punktu widzenia chemika ważne jest też to, że metale dążą do tworzenia związków o właściwościach raczej zasadowych i nukleofilowych niż kwasowych i elektrofilowych.
Jak wiadomo, wśród metali wyróżnia się klasę metali szlachetnych. Jest to zwyczajowa nazwa niereaktywnych chemicznie metali, do których zalicza się platynowce (ruten, rod, pallad, osm, iryd i platynę) oraz dwa pierwiastki z grupy miedziowców: srebro i złoto. Niektórzy dołączają do nich także ren i rtęć. Miedź, ze względu na nieco wyższą reaktywność, bywa nazywana metalem półszlachetnym.
Metale w stanie stałym występują w formie krystalicznej. Kryształy metali mogą mieć różnorodne formy. Jedną z nich są właśnie dendryty, będące swoistymi agregatami drobnych kryształów. Kształtem przypominają zwykle rozgałęzione pędy roślinne.
Formowanie się dendrytów wymaga odpowiednich warunków. Struktury te odznaczają się pięknem, a co więcej, ich studiowanie pozwala na wyciągnięcie pewnych wniosków co do natury procesów kształtujących wiele aspektów natury. Z tych właśnie powodów wyhodujemy srebrne dendryty!
Doświadczenie
Krystaliczne srebro w postaci dendrytów można otrzymać na dwa podobne, ale różniące się szczegółami sposoby. Każdy z nich zapewnia uzyskanie nieco odmiennego efektu, dlatego zachęcam szanownych Czytelników do wypróbowania obu wersji.
Jako źródło srebra w obu przypadkach zastosujemy azotan(V) srebra AgNO3. Związek ten bywa do dziś nazywany lapisem, ponieważ już alchemicy ochrzcili go terminem lapis infernalis (łac. kamień piekielny). Można się jednak zastanawiać dlaczego substancja, występująca w postaci białych kryształów (Fot.1) otrzymała tak demoniczną nazwę? Jednym z powodów był z całą pewnością fakt, iż pod wpływem światła w wyniku kontaktu AgNO3 ze skórą powstaje metaliczne srebro, co objawia się powstaniem czarnych, trudnych do usunięcia plam. Przebarwienia te znikają dopiero po kilku, kilkunastu dniach, wraz z łuszczącym się naskórkiem. Niech będzie to ostrzeżeniem, by przy pracy korzystać zawsze ze środków ochrony osobistej. Fartuch, rękawiczki i okulary ochronne są tu nieodzowne!
Zapoznajmy się więc ze sposobem przeprowadzenia proponowanych doświadczeń.
Wersja I
Do przeprowadzenia tej wersji doświadczenia musimy przygotować kilkuprocentowy, wodny roztwór azotanu(V) srebra AgNO3. Trzeba koniecznie użyć wody destylowanej lub demineralizowanej, ponieważ woda pochodząca z sieci wodociągowej zawiera zwykle zanieczyszczenia, które w reakcji z jonem srebrowym powodują powstanie wyraźnego zmętnienia. Ja zastosowałem roztwór o stężeniu około 3%. Dobierając różne stężenia można uzyskiwać zróżnicowane efekty, tak więc zachęcam czytelnika do eksperymentów.
Drugą konieczną rzeczą jest drut miedziany, najlepiej o średnicy w zakresie 0,2-0,5mm. Nie może być on pokryty izolacją, a powierzchniową warstwę tlenków i innych zanieczyszczeń należy usunąć poprzez oszlifowanie drobnoziarnistym papierem ściernym i przemycie acetonem.
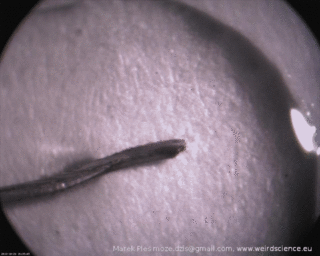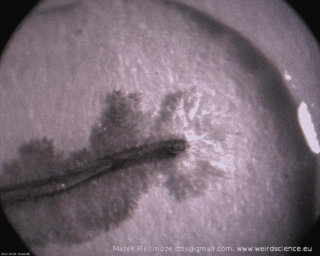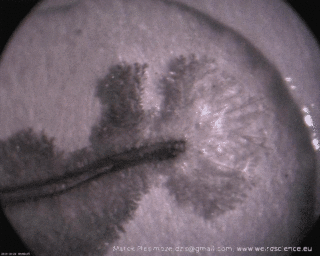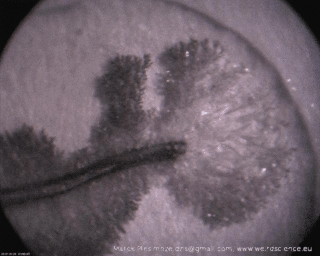
Wszystko gotowe? A więc połóżmy kilkucentymetrowy fragment miedzianego drucika na ciemnej powierzchni i zalejmy go kilkoma kroplami roztworu azotanu srebra. Dalszy rozwój wypadków dobrze jest obserwować przez szkło powiększające. Już po chwili na powierzchni drutu można łatwo zauważyć jakby błyszczący meszek (Fot.2A). Przerwanie obserwacji w tym momencie byłoby jednak błędem! Meszek rozrasta się bowiem w dalszym ciągu, w końcu formując piękne, rozgałęzione struktury zbudowane z metalicznego srebra (Fot.2B).
Wzrost struktur jest bardzo szybki – pojawianie się nowych odgałęzień i ich wydłużanie jest widoczne gołym okiem, czego dowodzi sekwencja obrazów widoczna na Fot.3.
Dokładniejsze przyjrzenie się powstałym dendrytom ujawnia ich subtelną, drzewiastą strukturę, co jest widoczne na zdjęciach w powiększeniu (Fot.4).
Doświadczenie można powtarzać wielokrotnie, za każdym razem usuwając kawałkiem bibuły filtracyjnej zredukowane srebro i wymieniając roztwór soli srebra.
Pozostałości roztworu AgNO3 nie wolno wylewać do zlewu, ponieważ nawet minimalne zanieczyszczenia solami srebra zabijają mikroorganizmy wykorzystywane w oczyszczalniach ścieków. Mimo wszystko usunięcie pozostałości roztworu nie jest trudne: srebro wystarczy zredukować poprzez wrzucenie do roztworu kilku kawałków blachy cynkowej lub granulek tego metalu. Wnikliwy czytelnik z pewnością zapyta:
-Dlaczego w tym przypadku wykorzystamy cynk, a nie miedź?
Oczywiście, można wykorzystać miedź. Jednak redukcja za pomocą cynku zajdzie znacznie szybciej. W tym przypadku niestety nie uzyskamy takich pięknych srebrnych struktur, a jedynie niepozorny ciemny osad silnie rozdrobnionego srebra, który można odsączyć i wykorzystać w innym celu.
Wersja II
W drugiej wersji doświadczenia do przygotowania roztworu soli srebra, oprócz azotanu(V) srebra AgNO3 potrzebujemy także wody amoniakalnej NH3(aq) o stężeniu około 25% [1].
Amoniak ulatniający się z wody amoniakalnej ma działanie drażniące, a w większych stężeniach jest trujący! Doświadczenia z wykorzystaniem tej substancji trzeba prowadzić pod sprawnym wyciągiem lub na zewnątrz.
Przygotowanie roztworu jest nieco bardziej skomplikowane [2]. Najpierw sporządzamy 50cm3 roztworu AgNO3 o stężeniu około 3%. Następnie, ciągle mieszając, dodajemy kropla po kropli wodę amoniakalną. Początkowo powstaje brunatny osad tlenku srebra(I) Ag2O w myśl równania reakcji:
W pewnym momencie, po dodaniu kolejnej kropli wody amoniakalnej osad ulegnie roztworzeniu, a roztwór stanie się klarowny. Dzieje się tak, ponieważ tlenek Ag2O reaguje z nadmiarem amoniaku dając w efekcie rozpuszczalny kompleks diaminasrebra(I) [Ag(NH3)2]+ według:
Ostrzegam: roztworu tego nie wolno przygotowywać na zapas i przechowywać, ze względu na możliwość powstawania po pewnym czasie tak zwanego srebra piorunującego o niezbyt dobrze poznanym składzie (uważane za azotek srebra Ag3N lub jego mieszaninę z imidkiem srebra Ag2NH) i silnych właściwościach wybuchowych. Roztwór pozostały po doświadczeniu należy jak najszybciej usunąć w opisany później sposób.
Do tej wersji doświadczenia potrzebujemy ponadto źródła prądu stałego o napięciu kilku woltów (np. baterii płaskiej 4,5V), odpowiednich przewodów i drutu o średnicy około 1mm, najlepiej stalowego – może być to wyprostowany spinacz biurowy.
Zestawienie potrzebnego układu nie jest trudne. Do płaskiego naczynia, np. szalki Petriego, wlewamy kilkucentymetrową warstwę uprzednio przygotowanego roztworu diaminasrebra(I), umieszczając na brzegu całkowicie zanurzoną anodę wykonaną z drutu stalowego. Katodę natomiast umieszczamy pośrodku naczynia. Ważne jest jednak, by dotykała ona jedynie granicy faz między wodą, a powietrzem. Zbyt głębokie zanurzenie katody może uniemożliwić otrzymanie oczekiwanego efektu. Gotowy układ przedstawia Fot.5A.
Natychmiast po podłączeniu elektrod do źródła napięcia na granicy faz wokół katody zaczynają się formować srebrzyste, rozgałęzione struktury (Fot.5B). Tym razem są one zdecydowanie większe niż w poprzednim przypadku, więc do ich obserwacji nie jest potrzebne żadne szkło powiększające. Proces ich formowania jest widoczny gołym okiem i trwa kilkadziesiąt sekund. Kształt otrzymanych w ten sposób drzewiastych dendrytów bywa naprawdę interesujący, szczególnie przy dokładniejszym przyjrzeniu się (Fot.6).
Pozostały po doświadczeniu roztwór należy zneutralizować poprzez delikatne zakwaszenie kwasem chlorowodorowym HCl, a następnie zredukowanie pozostałego srebra na powierzchni cynku, podobnie jak w poprzednim przypadku. Przypominam raz jeszcze: tego roztworu nie wolno przechowywać!
Wyjaśnienie
Jak często bywa, podstawy zachodzenia obserwowanych zjawisk nie są skomplikowane. W obu wersjach doświadczenia dochodzi do redukcji jonów srebra do wolnego srebra metalicznego.
W pierwszym przypadku srebro jest wypierane z roztworu na drodze reakcji z metaliczną miedzią. Jak wiemy, metale bardziej aktywne chemicznie, to jest o niższym potencjale standardowym E0, wypierają ze związków metale mniej aktywne, o wyższym potencjale. W przypadku srebra jego potencjał standardowy (mierzony względem elektrody wodorowej) wynosi 0,80V, a dla miedzi 0,34V [3]. Możemy więc zapisać zachodzącą reakcję:
Miedź roztwarza się, przechodząc w dwudodatnie kationy, zaś srebro ulega redukcji do postaci atomowej.
W drugim przypadku proces odbywa się na drodze elektrolitycznej: kation srebra ulega redukcji dzięki dostarczanym przez katodę elektronom:
Kation srebrowy ukazano tutaj w uproszczeniu jako jon prosty Ag+, ale pamiętajmy, że w rzeczywistości w reakcji uczestniczą jony kompleksowe [Ag(NH3)2]+.
W ten sposób dowiadujemy się wprawdzie w jaki sposób w przebiegu doświadczeniu uzyskujemy metaliczne srebro, ale nie tłumaczy to mechanizmu odpowiedzialnego za powstanie tak charakterystycznych struktur.
Wydzielone, metaliczne srebro jest doskonałym przewodnikiem elektrycznym, więc elektrony, czy to uwolnione z atomów miedzi (wersja I), czy dostarczone przez katodę (wersja II), mogą się przemieszczać do uformowanych już warstw srebra i umożliwiać dalszą redukcję metalu w tych miejscach. Początkowe niejednorodności w odkładaniu warstw, spowodowane zanieczyszczeniami, nieidealnym wymieszaniem roztworu, różnicami temperatury, dyfuzją, ruchami Browna i innymi czynnikami zostają wyolbrzymione, dając w efekcie strukturę sprawiającą wrażenie przypadkowej. Dokładne wyjaśnienie tego zjawiska wymaga nieco zastanowienia.
Dlaczego końcowe fragmenty metalicznych agregatów rosną zdecydowanie szybciej niż inne? Można to stosunkowo łatwo wyjaśnić faktem, że ładunek elektryczny ma tendencję do gromadzenia się w tych rejonach powierzchni ciała, które wykazują jak największą krzywiznę. Dzięki temu w dystalnych rejonach struktury gęstość ładunku jest największa, więc redukcja jonów srebra zachodzi tam najszybciej, co skutkuje jeszcze większą prędkością wydłużania się tej struktury. Jest to więc swoisty przykład dodatniego sprzężenia zwrotnego. Szczególnie dobrze widać to w II wersji doświadczenia, gdzie najdłuższe i najbardziej rozbudowane rozgałęzienia kierują się zawsze w stronę anody. Dzieje się to za sprawą oddziaływań elektrostatycznych. Jak wiemy, ładunki o przeciwnych znakach się przyciągają.
Takie wyjaśnienie nie jest jednak w dalszym ciągu pełne, ponieważ przy wspomnianych założeniach można się raczej spodziewać powstania długich i prostych struktur igiełkowatych. Natomiast w toku doświadczenia zaobserwowaliśmy liczne ich rozgałęzienia. Można to wytłumaczyć zjawiskiem agregacji ograniczonej dyfuzją (ang. diffusion-limited aggregation) [4]. Dla uproszczenia rozpatrzmy przykład w dwóch wymiarach, jednak model może być bez problemów odniesiony także do przestrzeni trójwymiarowej.
Załóżmy pewne nieruchome ciało nazywane ziarnem (ang. seed) umieszczone na rozpatrywanej powierzchni (Rys.1A). Po powierzchni poruszają się w sposób chaotyczny cząstki, które mogą zostać unieruchomione na powierzchni ziarna lub innych unieruchomionych już wcześniej cząstek. W ten sposób powstaje pewna struktura początkowa o przypadkowej budowie (Rys.1B).
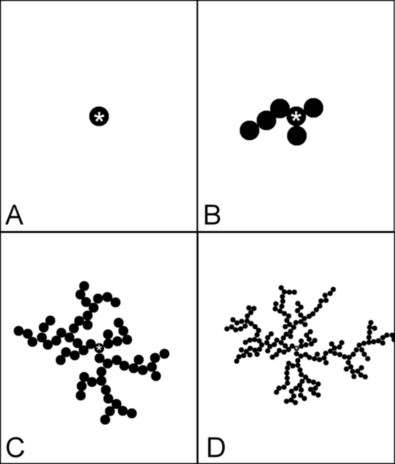
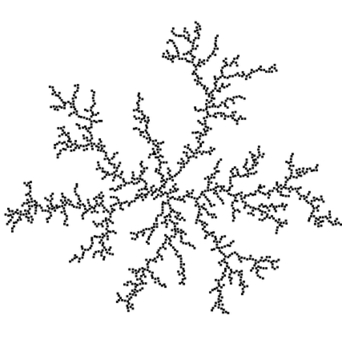
Logicznie rzecz biorąc, największe prawdopodobieństwo przyłączenia nowych cząstek będzie występowało nie w okolicach punktu centralnego, lecz na powstających w sposób przypadkowy rozgałęzieniach, z racji ich rozciągłości przestrzennej. Dzięki temu powstała struktura rozrasta się, zyskując drzewiastą, coraz bardziej rozgałęzioną formę (Rys.1C, D). Zaskakujące jest, że przy tak prostych założeniach ostatecznie wykształcają się struktury, które mogą wręcz zachwycać swoim geometrycznym pięknem (Rys.2). Rzuca się w oczy podobieństwo z otrzymanymi doświadczalnie dendrytami srebra (Fot. 4 i 6).
Model ten można bez trudności odnieść do sytuacji z jaką mieliśmy do czynienia w opisywanych doświadczeniach: ruchliwe jony srebra obecne w roztworze były redukowane na powierzchni metalu do nierozpuszczalnych, a więc unieruchomionych atomów srebra. Należy też zauważyć, że proces agregacji ograniczonej dyfuzją jest tu dodatkowo wspomagany wspomnianym wcześniej nierównomiernym rozmieszczeniem ładunku elektrycznego.
Opisane procesy nie są jedynie laboratoryjną ciekawostką – występują one także w naturze. Przykładem tego są choćby dendryty piroluzytu, dosyć powszechnie występującego minerału będącego krystaliczną odmianą tlenku manganu(IV) MnO2 (Fot.7). Agregaty piroluzytu bywają często mylone ze skamieniałościami roślin, lecz są całkowicie abiotycznego pochodzenia.
Analogiczne struktury można dostrzec także u roślin. Podobieństwo gałązki żywotnika zachodniego Thuja occidentalis do dendrytów otrzymanych sztucznie (np. srebrnych), czy też występujących w naturze (np. piroluzytu) nie jest przypadkowe. Istnieją godne zaufania przesłanki, że procesy molekularne odpowiedzialne za kształtowanie organów roślinnych są podobne, choć zapewne bardziej skomplikowane.
Występowanie struktur o budowie dendrytycznej w świecie ożywionym nie jest w żadnym razie ograniczone do roślin. Wystarczy wspomnieć choćby budowę zwierzęcych komórek nerwowych – posiadają one silnie rozgałęzione wypustki, nazywane także dendrytami.
Budowa opisanych struktur przywodzi na myśl także fraktale, czyli obiekty cechujące się samopodobieństwem [5]. Właściwość ta objawia się w ten sposób, że elementy fraktala są podobne do jego całości. Z racji olbrzymiej różnorodności obiekty te wymykają się ścisłej definicji. Interesujące jest, że mimo często wręcz niesamowitej komplikacji budowy (tzw. nieskończona subtelność), fraktale dają się zwykle opisać względnie prostą definicją rekurencyjną [6].
Zauważmy, w jaki interesujący sposób, wychodząc od w gruncie rzeczy nieskomplikowanych doświadczeń, przeszliśmy do rozważań bardziej zasadniczej natury. Nie jest więc konieczne posiadanie wartego miliony złotych sprzętu (chociaż bywa to przydatne), by móc wkroczyć na trop prawidłowości i zasad rządzących naszym światem. I to moim zdaniem jest piękne w nauce!
Literatura:
- [1] Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, Warszawa, 2001, str. 7-9 powrót
- [2] Dobrowolski J., Podręcznik chemii analitycznej, Państwowe Zakłady Wydawnictw Lekarskich, Warszawa, 1964, str. 203 powrót
- [3] CRC Handbook of Chemistry and Physics 88th, CRC Press, 2008 powrót
- [4] Witten T. A., Sander L. M., Diffusion-Limited Aggregation, a Kinetic Critical Phenomenon, Physical Review Letters 47, 1981 powrót
- [5] Barnsley M.F., Fractals Everywhere, Academic Press Professional, Boston, 1993 powrót
- [6] Falconer K., Techniques in Fractal Geometry, John Willey and Sons, 1997 powrót
Uzupełnienie autora
Szczególnych wrażeń dostarcza naoczna obserwacja wzrostu dendrytów srebra. Dobrze obrazuje to poniższy film, przedstawiający przebieg doświadczenia (wersja I).
Marek Ples







