Niezwykłe światło - o toksycznym chlorze i chemiluminescencji wzbudzonego azotu
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (4/2022):

Każdy kto śledzi moje prace wie, że bardzo sobie cenię wszelkie procesy fizyczne oraz chemiczne, które pozwalają na przedstawienie i wyjaśnienie różnorodnych zjawisk w interesujący, a także efektowny sposób. Jednym z typów tego rodzaju reakcji są te, podczas których dochodzi do chemiluminescencji. Cieszą się wielkim zainteresowaniem uczniów oraz nauczycieli, nie tylko ze względu na niewątpliwą wartość edukacyjną, ale też piękny i często zaskakujący efekt wizualny.
Chemiluminescencja jest zjawiskiem emisji promieniowania elektromagnetycznego z zakresu światła widzialnego na drodze innej niż ogrzanie danego ciała do odpowiednio wysokiej temperatury. Jednym z moich koników jest synteza i obserwacja chemiluminescencji oraz badanie czynników mających na nią wpływ wraz z możliwościami praktycznego wykorzystania. Fotografia 1 przedstawia niektóre z bardziej znanych i wchodzących w skład mojej kolekcji substancji o właściwościach chemiluminescencyjnych wyprodukowanych w prywatnej pracowni; są to lofina C21H16N2, lucygenina C28H22N4O6, chlorek tris(2,2'-bipirydylo)rutenu(II) [Ru(bpy)3]Cl2 i luminol C8H7N3O2 [1] [2].
Wszystkie wspomniane substancje podczas utleniania (w odpowiednich rozpuszczalnikach) emitują światło o charakterystycznej długości fali, a więc także i barwie (Fot.2).
Przedstawione substancje – chociaż stosunkowo nieskomplikowane w syntezie i będące całkowicie w zasięgu prac w laboratorium uczelnianym – to z punktu widzenia pracowni szkolnej lub amatorskiej mogą być trudniejsze do pozyskania, choćby ze względu na koszty półproduktów do syntezy. Omawiane zjawisko można zaobserwować także w przypadku chemikaliów dużo łatwiejszych w syntezie lub do zdobycia. Do chemiluminescencji zmusić można białą odmianę alotropową fosforu P, metale alkaliczne: sód Na i potas K, tlen singletowy 1O2, polifenole wchodzące w skład zielonej herbaty, niektóre związki magnezoorganiczne i krzemoorganiczne (siloksen Wöhlera Si6O3H6 wytworzony z krzemionki SiO2), a nawet łatwo dostępny w aptekach manganian(VII) potasu KMnO4 [3] [4] [5]. Znanych jest oczywiście dużo więcej substancji chemiluminescencyjnych, także spotykane w naturze (bioluminescencja) i wykorzystywanych np. przez występujące w Polsce chrząszcze Coleoptera z gatunków świetlik świętojański Lampyris noctiluca, świeciuch Phosphaenus hemipterus i iskrzyk Phausis splendidula [6]. Innym przykładem organizmów wykazujących bioluminescencję są morskie bakterie z gatunku Aliivibrio fischeri. Bakterie te są w normalnych warunkach zupełnie nieszkodliwe dla człowieka i udało mi się je wyizolować w warunkach mojej pracowni z powierzchni ciała organizmów morskich (ryb, krewetek; wymagało to jednak sporej ilości prób i cierpliwości), a następnie namnożyć na odpowiedniej pożywce – koliste kolonie tych mikroorganizmów świecą wyraźnie widocznym niebieskim blaskiem (Fot.3).
Poza mniej lub bardziej, ale jednak dosyć powszechnie znanymi reakcjami chemiluminescencyjnymi istnieją też takie, o których słyszy się i czyta dużo rzadziej. W wielu przypadkach powodem jest skąpa ilość informacji dostępna na ten temat w literaturze krajowej, a czasem także zagranicznej. Bywa też tak, że jest to spowodowane niezbyt widowiskowym efektem wizualnym rozpatrywanej reakcji lub niedostępnością i często także ceną potrzebnych reagentów. Aby zmienić nieco taki stan rzeczy, chciałbym dzisiaj zachęcić Szanownego Czytelnikoa do zapoznania się – i oczywiście samodzielnego przeprowadzenia – z pewną reakcją, która mimo że produkowany podczas niej blask jest wyraźnie dostrzegalny (porównywalny lub nieco słabszy w moim odczuciu do tego powstającego podczas reakcji tlenu singletowego), a potrzebne reagenty są bardzo tanie, to jest prawie nie znana. Muszę jednak przyznać, że wspomniana reakcja, chociaż w założeniach bardzo prosta, to jednak aby ją przeprowadzić bezpiecznie jest konieczna duża staranność przy przygotowaniu aparatury.
Zanim przystąpimy do rzeczy, dla bezpieczeństwa – ale też z ciekawości – musimy się zapoznać z właściwościami jednego z potrzebnych nam reagentów.
Chlor
Chlor Cl jest pierwiastkiem chemicznym o liczbie atomowej 17 (stabilne izotopy: 35Cl i 37Cl) z grupy fluorowców, jest typowym niemetalem. Jego nazwa (zarówno łacińska, jak i pochodząca od niej polska) ma swój źródłosłów w klasycznej grece, w której słowo χλωρός (chloros) oznaczało barwę zielonożółtą. I rzeczywiście, chlor jest gazem o właśnie takiej barwie i gęstości ponad dwa razy większej od powietrza (Fot. 4). Ma nieprzyjemny duszący zapach.
Chlor występuje w przyrodzie praktycznie wyłącznie w postaci związków chemicznych. Pierwiastek ten ma duże znaczenie biologiczne i wchodzi w skład makroelementów. Jony chloru należą do głównych anionów w płynach organizmu, a kwas chlorowodorowy jest używany do aktywacji enzymów trawiennych przez wiele zwierząt. Ocenia się, że w organizmie człowieka o wadze 70kg znajduje się około 95g chloru.
Wolny chlor, podobnie jak większość pozostałych gazów w warunkach normalnych, występuje w postaci dwuatomowych cząsteczek Cl2. W związkach występuje na stopniach utlenienia od -I do VII.
Chlor jest bardzo aktywny chemicznie, chociaż mniej niż fluor. Reaktywność fluorowców znalazła odzwierciedlenie w innej nazwie tej grupy pierwiastków; określa się je często halogenami (od gr. ἁλός „sól” i γένος „tworzyć”). Chlor jest zdolny do reagowania z większością pierwiastków, w wyniku czego powstają m.in. chlorki. W 1 litrze wody o temperaturze 25 °C rozpuszcza się 2,3 litra chloru, tworząc tzw. wodę chlorową stanowiącą dosyć powszechnie wykorzystywany w praktyce laboratoryjnej odczynnik [7].
Omawiany pierwiastek używany jest w instalacjach do uzdatniania wody, na ostatnim etapie procesu, gdzie w jego reakcji z wodą tworzy się posiadający silne właściwości dezynfekujące kwas chlorowy(I) HClO oraz HCl. Produktem ubocznym podczas nieodpowiedniego procesu chlorowania wody może być toksyczny dla ludzi chloroform, powstający w reakcji chloru ze związkami organicznymi występującymi w niedokładnie oczyszczonej wodzie.
Podczas I wojny światowej były prowadzone próby z wykorzystaniem chloru jako gazu bojowego [przez Niemców, przyp. aut.], ale pierwiastek ten został wyparty przez bardziej skuteczne (czyt. jeszcze bardziej barbarzyńskie) środki [8].
W chemii organicznej używa się wolnego chloru jako utleniacza; często jednak zamiast gazu wykorzystuje się wspomnianą już wcześniej wodę chlorową. Pierwiastek ten jest jednym z szeroko stosowanych podstawników, zastępującego w związkach organicznych atom wodoru, dzięki czemu wykorzystuje się go przy produkcji bardzo różnorodnych materiałów: tworzyw sztucznych, antyseptyków, barwników, środków owadobójczych, produktów naftowych, lekarstw, wyrobów włókienniczych, rozpuszczalników i innych.
Wolny chlor został otrzymany w reakcji tlenku manganu(IV) MnO2 z kwasem chlorowodorowym HCl(aq) po raz pierwszy w 1774 przez Carla Wilhelma Scheele, który mylnie sądził, że jest to jakiś związek chemiczny zawierający tlen. Wiązało się to z faktem, że w owych czasach uważano, że praktycznie wszystkie kwasy zawierają w swojej strukturze tlen (nie rozumiano jeszcze koncepcji kwasu beztlenowego). Z tego powodu przez pewien czas sądzono, że substancja otrzymana przez Scheele’go jest tlenkiem jakiegoś nie odkrytego jeszcze w stanie wolnym pierwiastka – otrzymał on nawet swoją nazwę: Murium lub Muriaticum [9].
Dopiero w 1810 roku Humphry Davy stwierdził, że substancja otrzymana przez Sheelego jest nie jest tlenkiem hipotetycznego pierwiastka, lecz samym pierwiastkiem i nadał mu nazwę łacińską chlorum [10]. Jędrzej Śniadecki jako jeden z pierwszych postulował uznanie chloru za pierwiastek, tuż po jego odkryciu. Polską nazwę zaproponował Filip Walter.
Na skalę laboratoryjną chlor możemy wyprodukować między innymi w ten sam sposób co jego odkrywca, w myśl reakcji:
| (1) |
Możemy też zastosować manganian(VII) potasu, działając na niego podobnie jak w poprzedniej reakcji kwasem chlorowodorowym:
| (2) |
W moich doświadczeniach wykorzystałem jednak jeszcze inną reakcję, a mianowicie tę, w której kwas reaguje z chloranem(I) wapnia Ca(ClO)2, handlowo nazywanym wapnem chlorowanym. Substancja ta jest powszechnie stosowana do przygotowywania roztworów odkażających np. baseny kąpielowe lub do bielenia papieru, tkanin i innych materiałów. Wspomnianą reakcję opisuje równanie:
| (3) |
Reakcja ta jest najekonomiczniejsza jeśli chodzi o stosunek zużytego kwasu do wyprodukowanego chloru. Z mojego doświadczenia wynika także, że przebiega najmniej gwałtownie i odpowiednio dozując kwas można z łatwością uzyskać odpowiedni, niezbyt szybki a jednocześnie równomierny dopływ produkowanego chloru. Fotografia 5 przedstawia mieszaninę reakcyjną, gdzie widoczna jest zielonkawa barwa gazu nad mieszaniną reagentów. Jest to właśnie wolny chlor, odprowadzany dalej odpowiednią rurką.
Ważne jest, aby nie stosować rurek z gumy lub niektórych innych tworzyw, ponieważ zostaną one bardzo szybko zniszczone przez gazowy chlor, co może doprowadzić do niebezpieczeństw. Dosyć dobrze nadają się tutaj węże silikonowe, ale należy każdorazowo dokładnie sprawdzać ich szczelność przed doświadczeniami.
Przy wszelkich doświadczeniach z chlorem musimy pamiętać, że pierwiastek ten działa silnie drażniąco na układ oddechowy i błony śluzowe, może prowadzić do obrzęku płuc, a w dużych stężeniach do śmierci. W powietrzu jego zapach jest wyczuwalny już przy stężeniu 3,5ppm, a stężenie śmiertelnie niebezpieczne to powyżej 800ppm [11]. Wartość średnia ważona dopuszczalna w długim przedziale czasu (8 godzin na dzień) nie powinna przekroczyć 0,7mg/m3, a najwyższe dopuszczalne stężenie chwilowe (NDSCh) wynosi 1,5mg/m3. Nie wolno więc nam zapominać o odpowiednich środkach bezpieczeństwa – wszystkie doświadczenia z gazowym chlorem muszą się odbywać pod działającym wyciągiem.
Będącą jednym z powodów toksyczności chloru reaktywność tego pierwiastka można przedstawić w bardzo efektowny sposób. Przydadzą się nam w tym celu kwiaty – im bardziej kolorowe, tym lepiej. W swoich próbach zastosowałem kwiaty będące pod ręką, pochodzące z mojego ogrodu. Pierwszych doświadczeń dokonałem z wykorzystaniem kwiatów, czy raczej kwiatostanów (w formie koszyczka anthodium) słoneczniczka szorstkiego Heliopsis helianthoides. Kwiatostan został zawieszony na fragmencie izolowanego drutu miedzianego w pojemniku (Fot.6).
Naczynie z kwiatostanem zostało przykryte dużą szklaną szalką Petriego, a następnie wypełnione chlorem. Strukturę roślinną pozostawiono w atmosferze chloru na około 15 minut, po czym wydobyto na powietrze, tak by pozostałości toksycznego gazu mogły się w bezpieczny sposób ulotnić. Efekt doświadczenia ilustruje Fot.7.
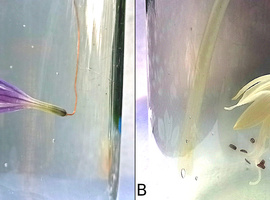
Jak widać, w przypadku kwiatostanów słoneczniczka brzeżne kwiaty języczkowe (upodabniające się do płatków korony i pełniące podobną rolę) są naturalnie żółte (Fot.7A), natomiast po ekspozycji na gazowy chlor doszło do prawie całkowitego ich odbarwienia (Fot.7B). Kwiatostan słoneczniczka ma dosyć mięsistą budowę i odbarwienie nie było całkowite – najprawdopodobniej chlor w czasie doświadczenia nie zdążył wniknąć do głębiej położonych tkanek rośliny i dlatego w dalszym ciągu zauważalne jest delikatnie żółtawe zabarwienie. Wykorzystanie w ten sam sposób delikatniejszych kwiatów funkii Hosta sp. daje nawet bardziej spektakularny efekt – naturalnie fioletoworóżowe płatki (Fot.8A) już po 3 minutach w atmosferze chloru stały się praktycznie bezbarwne (Fot.8B). Daje się też zauważyć spadek wytrzymałości mechanicznej tkanek roślinnych po ekspozycji na omawiany gaz.
Wręcz niszczycielskie działanie miał chlor na kwiatostany (baldachogrona corymbus) płomyka wiechowatego Phlox paniculata, nazywanego często po prostu floksem. Istnieją odmiany tej rośliny o kwiatach różnej barwy, ja zastosowałem fioletowe (Fot.9A).
W tym przypadku już po kilkunastu sekundach doszło do wyraźnego odbarwienia płatków kwiatów, a także praktycznie całkowitego zwiotczenia i utraty naturalnej formy (Fot.9B).
Przedstawione doświadczenie przekonuje nas, że chlor jest silnie reaktywnym gazem, ponieważ z łatwością utlenia i niszczy m.in. barwniki (antocyjany i inne) zawarte w strukturach roślinnych. W wielu przypadkach dzieje się to tym szybciej, im więcej dana tkanka zawiera wody, ponieważ w kontakcie z nią chlor przejawia dużo silniejsze działanie bielące niż na sucho.
Oczywiście chlor nie uszkadza jedynie barwników, ale także wiele innych substancji organicznych i nieorganicznych. Dlatego chlorowe wybielacze mogą niszczyć tkaniny.
Opisana prezentacja właściwości chloru, poza ciekawym efektem wizualnym niesie jeszcze tę zaletę, że po takim pokazie chyba nikt nie będzie negował konieczności zachowania ostrożności przy manipulacji tą substancją. Możemy więc przejść do głównego tematu, jakim jest chemiluminescencja z udziałem gazowego chloru.
Zimne światło
Chlor do doświadczenia wytworzymy w jego trakcie z wykorzystaniem reakcji (3), więc potrzebujemy:
- chloran(I) wapnia Ca(ClO)2,
- kwas chlorowodorowy HCl(aq) (Cp ≈ 18%),
- woda amoniakalna stężona (30%) NH3(aq),
- wodorotlenek sodu NaOH [12].
Jak widać, tym razem właściwie wszystkie zastosowane substancje mogą być w jakiś sposób niebezpieczne. Chloran(I) wapnia jest silnym utleniaczem – jego mieszaniny z energicznymi reduktorami mogą mieć właściwości wybuchowe. W kontakcie z wodą, kwasami i zasadami wywiązuje trujący chlor. Kwas chlorowodorowy i roztwory wodorotlenku sodu są silnie żrące i z łatwością mogą uszkodzić naszą skórę i oczy. Woda amoniakalna jest mocną zasadą, a wywiązujący się z niej amoniak ma działanie drażniące i w większych stężeniach jest trujący. Konieczne jest stosowanie odpowiednich środków ochronnych, a prace przygotowawcze i samo doświadczenie musimy prowadzić pod wydajnie działającym wyciągiem.
Przystępując do doświadczenia warto zbudować odpowiednią aparaturę, której schemat przedstawiłem na Rys.1.
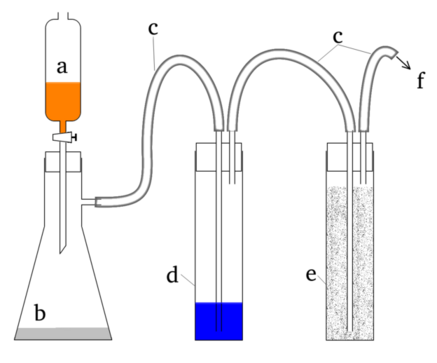
Jak widać, układ doświadczalny składa się z kilku elementów. W rozdzielaczu a znajduje się 50cm3 kwasu chlorowodorowego o stężeniu około 18%. Sam rozdzielacz jest umieszczony w szczelnym korku gumowym (izolowanym parafiną) zamykającym kolbę ssawkową b zawierająca 15g chloranu(I) wapnia. Ten układ naczyń tworzy razem oczywiście wytwornicę chloru, który jest następnie za pomocą węża silikonowego c kierowany do dłuższej rurki płuczki Dreschla d zawierającej kilkadziesiąt mililitrów stężonej wody amoniakalnej. Wylot naczynia jest podłączony do wlotu kolejnej płuczki e, tym razem zawierającej 30% roztwór wodny wodorotlenku sodu, albo nawet lepiej luźno ułożone wióry drewniane nasączone takim roztworem. Wylot tej płuczki za pomocą kolejnego węża silikonowego jest skierowany bezpośrednio do wyciągu. Cały zestaw doświadczalny można zobaczyć na Fot.10. Jeśli chcemy zestawić układ wcześniej, warto dokładnie zamknąć (np. zaciskaczem) rurkę łączącą wytwornicę chloru z pierwszą płuczką. Połączenie można otworzyć tuż przed lub po rozpoczęciu wywiązywania chloru – w tym drugim przypadku jednak trzeba uważać, aby nie powstało zbyt wysokie ciśnienie. W każdym przypadku trzeba dbać o to, aby wszystkie węże, rurki szklane i ich połączenia zapewniały jednocześnie szczelność i drożność całego układu, tak by nie doszło do przesadnego wzrostu ciśnienia, a w efekcie rozsadzenia aparatury.
Wodę amoniakalną najlepiej jest umieścić w płuczce tuż przed rozpoczęciem doświadczenia (Fot.11).
Myślę, że Czytelnik domyśla się już, że głównym naczyniem reakcyjnym, w którym będzie miał miejsce interesujący nas proces jest płuczka zawierająca wodny roztwór amoniaku. Druga płuczka wypełniona roztworem wodorotlenku sodu stanowi pochłaniacz większości nieprzereagowanego wcześniej chloru. Układ opuszcza jednak pewna niewielka, ale - z racji toksyczności – znacząca ilość gazowego chloru, więc wylot musi być skierowany w odpowiedni sposób do wyciągu.
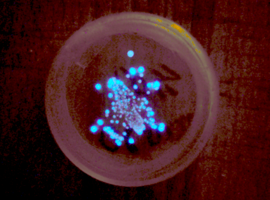
Chcąc rozpocząć doświadczenie zaciemniamy pomieszczenie i odkręcając delikatnie kran rozdzielacza doprowadzamy do zmieszania się kwasu z chloranem(I). Po dodaniu kwasu zakręcamy kran i obserwujemy wywiązywanie się chloru, który po chwili zaczyna w postaci pęcherzyków przepływać wartkim strumieniem przez roztwór amoniaku w pierwszej płuczce, podczas czego można zauważyć rozbłyski żółtego światła. Jest ono wyraźnie widoczne gołym okiem i udaje się zarejestrować za pomocą aparatu fotograficznego (Fot.12).
Rozbłyski światła trwają tak długo, jak trwa intensywny przepływ chloru i póki nie spadnie stężenie amoniaku. Jednocześnie można zauważyć wywiązywanie się gazu w całej objętości cieczy w płuczce.
Doświadczenia nie należy prowadzić zbyt długo, ponieważ może dochodzić do powstawania pewnych ilości niebezpiecznego trichlorku azotu NCl3 (trichloroaminy) – po zaobserwowaniu chemiluminescencji wytwornicę chloru należy odłączyć od naczynia z amoniakiem i skierować szczątkowy strumień chloru do pochłaniacza. Po doświadczeniu należy odczekać aż wytwornica chloru przestanie pracować, a następnie przewietrzyć całą aparaturę pod wyciągiem przed zabiegami mającymi na celu jej oczyszczenie.
Fotografia 13 przedstawia to samo doświadczenie, lecz przeprowadzone w kolbie Erlenmeyera.
Wyjaśnienie
Ciekawą sprawą jest fakt, że opisywana reakcja była dawniej bardzo często prowadzona w szkolnych i uczelnianych pracowniach jako przykład możliwości utlenienia amoniaku do wolnego azotu właśnie przy wykorzystaniu chloru. Albrecht wraz z zespołem zanotowali z niejakim zdziwieniem (także dla mnie jest to zaskakujące), że mimo powszechnego wykorzystania w celach edukacyjnych tej reakcji prawie nigdy uwaga prowadzących i widzów nie była zwracana na fakt zachodzącej wtedy łatwo widocznej chemiluminescencji [13].
W zasadowym roztworze dochodzi najprawdopodobniej do reakcji w myśl równań:
| (4) |
| (5) |
Jak widać, pierwsza z nich to reakcja amoniaku bezpośrednio z chlorem, zaś druga z anionem chloranowym(I) [14]. Jeśli zostają zachowane opisane warunki to nie dochodzi do tworzenia większych ilości trójchlorku azotu NCl3.
W dalszym ciągu nie jest dokładnie zbadany mechanizm powstawania w opisanej reakcji żółtego światła. Niektórzy badacze postulują mechanizm oparty na wzbudzeniu mogącej powstawać w opisanych warunkach chloraminy ClNH2, ale maksimum emisji przypada wtedy na fale elektromagnetyczne o długości 690nm, co odpowiada światłu czerwonemu [15]. Nie zgadza się to oczywiście z obserwacją w opisanym doświadczeniu, ponieważ powstaje tutaj światło żółte.
Istnieją jednak przesłanki, że mechanizm chemiluminescencji opiera się w tym przypadku na wzbudzeniu powstającego w reakcji azotu [16]. Azot w wyniku reakcji powstaje najprawdopodobniej w wysokowzbudzonym stanie tripletowym T2. Żółte światło hν może pochodzić z dozwolonego przejścia ze wzbudzonego stanu tripletowego T2 do tripletowego stanu podstawowego T1, po czym zachodzi przejście bezpromieniste do podstawowego stanu singletowego S0:
| (6) |
| (7) |
Opisany mechanizm jest podobny w swojej istocie do chemiluminescencji z udziałem tlenu singletowego, z tą różnicą, że w jego przypadku stanem podstawowym jest forma trypletowa (oznaczana jako 3O2) o dwóch niesparowanych elektronach w cząsteczce, będąca więc rodnikiem. Natomiast wzbudzona cząsteczka ze wszystkimi sparowanymi elektronami występuje w stanie singletowym 1O2. Istnieją dwie odmiany stanu singletowego tlenu, różniące się sposobem rozmieszczenia elektronów na orbitalach molekularnych π*2p. Zauważmy, że w przypadku tlenu zachodzi nietypowa sytuacja - tlen trypletowy występuje w stanie podstawowym, zaś singletowy o całkowicie sparowanych elektronach odpowiada stanom wzbudzonym o wyższej energii.
Trzeba wspomnieć jeszcze o tym, że w pochłaniaczu chloru zachodzi reakcja:
| (8) |
Zachęcam każdego do własnych doświadczeń – oczywiście pod warunkiem zachowania bezpieczeństwa!
Literatura:
- [1] Ples M., Synteza i chemiluminescencja lofiny - zimne światło, muzyka i migdały, Chemia w Szkole, 5 (2020), Agencja AS Józef Szewczyk, str. 44-47 powrót
- [2] Ples M., Pulsujące światło - chemiluminescencyjne oscylacje, Chemia w Szkole, 3 (2019), Agencja AS Józef Szewczyk, str. 44-48 powrót
- [3] Ples M., Chemiluminescencja metalicznego sodu, Chemia w Szkole, 1 (2014), Wydawnictwo EduPress, str. 5-7 powrót
- [4] Ples M., Całkiem niezwykła herbatka, Chemia w Szkole, 4 (2015), Agencja AS Józef Szewczyk, str. 6-9 powrót
- [5] Ples M., Fiolet świeci - chemiluminescencja powszechnie dostępnego związku manganu, Chemia w Szkole, 6 (2018), Agencja AS Józef Szewczyk, 16-19 powrót
- [6] Ples M., Iskrzyk - żywa latarnia, Biologia w Szkole, 4 (2021), Forum Media Polska Sp. z o.o., str. 52-56 powrót
- [7] Bielański A., Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN, Warszawa, 2002, str. 563 powrót
- [8] Ellison D.H., Handbook of Chemical and Biological Warfare Agents - Second Edition, CRC Press, 2007, str. 567-570 powrót
- [9] Weeks M. E., The discovery of the elements. XVII. The halogen family, Journal of Chemical Education. 1932, 9 (11): str. 1915-1939 powrót
- [10] Eichstaedt I., Księga pierwiastków, Wiedza Powszechna, Warszawa, 1973, str. 180 powrót
- [11] Sitarek K., Chlor - dokumentacja dopuszczalnych wielkości narażenia zawodowego, w: Podstawy i Metody Oceny Środowiska Pracy, 55 (1/2008), str. 73-95, 2008 powrót
- [12] Seidl M., Chemolumineszenz mit Ammoniak und Chlor, w serwisie: https://www.chem-page.de, dostępne online: https://www.chem-page.de/experimente/chemolumineszenz-mit-ammoniak-und-chlor.html [dostęp 01.08.2022] powrót
- [13] Albrecht S., Brandl H., Zimmermann T., Anorganische Chemilumineszenz. Traditionelle Experimente in neuem Licht, Chemie in unserer Zeit, 2008, 42 (6), str. 394-400 powrót
- [14] Bray W. C., Dowell C. T., The reactions between chlorine and ammonia, Journal of the American Chemical Society, 1917, 39(5), 905-913 powrót
- [15] Maeda Y., Takenaka N., Chemiluminescence determination of trace amounts of ammonia and halogen species in the environment, International Society for Optics and Photonics: Bellingham (Washington, USA), 1993, str. 185-193 powrót
- [16] Brown R., Winkler C. A., The Chemical Behavior of Active Nitrogen, 1970, 9(3), str. 181-196 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples