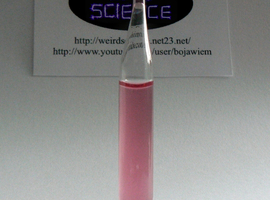
Ciecz zmieniająca barwę wraz z temperaturą
Świat kolorów
Barwy otaczają nas ze wszystkich stron, dzięki nim świat wydaje się ciekawszy i bardziej interesujący. Jako jedni z niewielu przedstawicieli świata zwierzęcego posiadamy zdolność do widzenia wszystkich barw światła widzialnego; powinniśmy być za to wdzięczni naturze. Kolory są też tworzywem i inspiracją dla wielu dziedzin sztuki, nie tylko dla malarstwa. Literatura też niejednokrotnie czerpała, czerpie i będzie czerpać z tego bogatego źródła; dzięki barwom i odcieniom można wyrazić zaskakująco wiele. W jednej z ciekawszych współczesnych powieści możemy przeczytać:
A śnieg padał. Jak sen, deformował kształty i barwy, ukrywając wszystko, co znajome, grzebiąc wszystko, co prawdziwe.
Deformować barwy? Ten poetycki zwrot niewątpliwie niesie w sobie wiele treści. Co to jednak ma wspólnego z chemią?
Otóż chemia jest przecież właśnie niezwykle barwną nauką! Większość (a właściwie wszystkie) kolory, jakie widzimy wokół siebie są w jakiś sposób związane z tą dziedziną wiedzy.
Dla tych, którym statyczne kolory wydają się być nudne, przygotujemy dziś ciecz reagującą zmianami barwy na wzrost lub spadek temperatury. Dodatkowo, prezentowane doświadczenie w ciekawy sposób wprowadza w dziedzinę termodynamiki chemicznej.

Potrzebne materiały
Na szczęście lista potrzebnych substancji jest krótka; potrzebujemy:
- chlorek kobaltu(II), heksahydrat CoCl2·6H2O,
- chlorek sodu NaCl.
Ostrzeżenie: Chlorek kobaltu(II) CoCl2·6H2O jak większość związków metali ciężkich jest toksyczny. Najprawdopodobniej wykazuje też działanie rakotwórcze. Nie można pozwolić na jego kontakt ze skórą! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Chlorek kobaltu(II) CoCl2·6H2O musimy nabyć w sklepie chemicznym, ale jako chlorek sodu NaCl wystarczy zwykła sól kuchenna.
W pełni uwodniony chlorek kobaltu(II) ma postać intensywnie czerwonych kryształków:
Musimy przygotować kilkuprocentowy roztwór chlorku kobaltu(II) CoCl2·6H2O w nasyconym w temperaturze pokojowym roztworze chlorku sodu NaCl. Najlepiej przyrządzić najpierw nasycony roztwór soli kuchennej, wrzucić do niego kilka kryształków CoCl2·6H2O i mieszając dolać powoli tyle wody, by sól kobaltu uległa rozpuszczeniu. Tak przygotowany roztwór ma barwę różową.
Pokaz!
Do probówki wlewamy niewielką ilość przygtowanego uprzednio roztworu. Jak już wcześniej wspomniałem, roztwór jest różowy. Przekonuje nas o tym także poniższe zdjęcie.
Teraz możemy w dowolny sposób ogrzać zawartość probówki. Już niewielki wzrost temperatury powoduje wyraźną zmianę odcienia. W ciągu dalszego ogrzewania zmiana ta jest coraz wyraźniejsza. Jeszcze przed rozpoczęciem wrzenia, ciecz zmienia barwę na ciemnoniebieską:
Należy wspomnieć, że zmiana barw ma charakter całkowicie odwracalny: po ochłodzeniu zostaje przywrócona barwa pierwotna.
Prezentowane zjawisko mozna wykorzystać do zbudowania pomysłowego termometru: wystarczy zamknąć odrobinę opisywanej cieczy w zatopionej ampułce szklanej. Ampułkę taką wykonałem własnoręcznie, wyciągając i formując w płomieniu palnika gazowego niewielką probówkę. Zdjęcia poniżej przedstawiają taki chemiczny termometr mojej produkcji, w różnych temperaturach.
Pamiętajmy, że wewnątrz jest zamknięta toksyczna sól metalu ciężkiego, jednak dokładne zatopienie ampułki jest gwarancją nieszkodliwości tak przygotowanego przyrządu.
Wyjaśnienie
Podstawą zaobserwowanego efektu jest zasada przekory. W roztworze wodnym chlorku kobaltu(II) dochodzi do utworzenia równowagi dynamicznej między dwoma rodzajami kompleksów kobaltu. Można tu zilustrować równaniem:
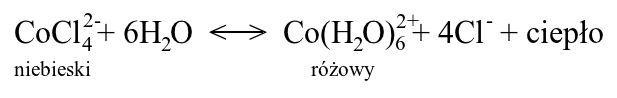
Kompleks chlorkowy wykazuje intensywnie niebieską barwę, zaś akwakompleks różową. W roztworze wodnym równowaga reakcji jest silnie przesunięta w prawo i nawet podgrzanie nie powoduje wyraźnej zmiany barwy. Dodatek dużej ilości jonów chlorkowych (w postaci NaCl) powoduje pewne przesunięcie równowagi w lewo, jednak nie na tyle, by w temperaturze pokojowej dać przewagę kompleksowi chlorkowemu. Nie obserwujemy więc zmiany barwy. Sytuacja zmienia się po podgrzaniu: wtedy zgodnie z zasadą przekory równowaga przesunie się zdecydowanie w stronę kompleksu chlorkowego, co objawi się zmianą koloru na niebieski. Przy spadku temperatury równowaga przesuwa się w przeciwną stronę, zaczyna więc znowu dominować różowy akwakompleks.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Kamlet M.J., Abboud J.L., Taft R.W., The solvatochromic comparison method. 6. The π* scale of solvent polarities, Journal of American Chemical Society, 1977, 99(18), str. 6027–6038
- Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 211-213, 239
- Reichardt Ch., Welton T., Solvents and solvent effects in organic chemistry, Wiley-VCH., 2010, str. 360
Marek Ples