Zatrzymać niewidzialne
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (4/2019):

Jako, że lato jest w pełni – przynajmniej w czasie, kiedy piszę niniejszy artykuł – wydaje się być zasadne, aby poświęcić chwilę na zastanowienie nad wpływem promieniowania słonecznego na nasz organizm. Pomijając pozostałe składowe promieniowania słonecznego, zajmiemy się dziś tą, która jest zwykle opisywana jako najbardziej szkodliwa.
Promieniowanie o długości fali mniejszej niż widoczne dla naszych oczu i jednocześnie większej niż dla promieniowania rentgenowskiego, a więc w przybliżeniu o zakresie od 10 nm do 400 nm nazywamy ultrafioletem (ang. ultraviolet, UV). Niektóre źródła za dolną granicę długości fali ultrafioletu przyjmują wartość 100 nm. Wspomniana nazwa ma źródło łacińskie (łac. ultra - ponad, poza) i nic dziwnego, że promieniowanie takie jest nazywane także nadfioletem. W moim odczuciu bardzo sympatyczne i budzące miłe skojarzenia jest określenie "promienie nadfiołkowe" (lub "pozafiołkowe"), spotykane w dawniejszych książkach i publikacjach naukowych [1]. Ultrafiolet został odkryty w XIX wieku, ale jak w wielu przypadkach bywa, uczyniło to niezależnie od siebie dwóch badaczy: fizyk Johann Wilhelm Ritter i chemik William Hyde Wollaston.
Ultrafiolet, jako promieniowanie niosące stosunkowo dużą energię ma określone działanie na organizmy żywe. Właśnie z tego względu dokonano podziału na pewne umowne zakresy:
- UV-C – długość fali: 100–280 nm
- UV-B – długość fali: 280–315 nm
- UV-A – długość fali: 315–380 nm
Jak widać, najbliższe zakresowi widzialnemu jest promieniowanie UV-A, możemy więc powiedzieć w przenośni, że jest ono jedynie nieco bardziej fioletowe niż sam fiolet. Jest ono też stosunkowo najmniej szkodliwe. Nie znaczy to jednak, że jest ono całkowicie bezpieczne dla nas, ponieważ dłuższa ekspozycja prowadzi do uszkodzeń włókien kolagenowych budujących skórę, co przyspiesza procesy starzenia. Duże dawki UV-A mogą powodować zmętnienie soczewki oka czyli zaćmę. Nie dotyczy to promieniowania UV-B i UV-C, ponieważ są one pochłaniane przez rogówkę, jako warstwę osłaniającą gałkę oczną.
Wiemy, że promieniowanie z zakresu UV-B powoduje wytwarzanie w skórze potrzebnego naszemu organizmowi cholekalcyferolu C27H44O czyli witaminy D3. Wymaga to jednak jedynie bardzo niewielkich dawek tego rodzaju światła. Ekspozycja na większe dawki promieniowania UV-B i UV-C jest bardzo niebezpieczna, ponieważ sprzyja powstawaniu nie tylko różnego rodzaju rumieni skóry, ale także nowotworów (w tym niebezpiecznego nowotworu wywodzącego się z melanocytów, czyli komórek barwnikowych skóry - czerniaka złośliwego), a także uszkodzeń DNA. Wysokoenergetyczne promieniowanie UV ma więc działanie mutagenne [2].
Jest więc jasne, że mimo chęci do modnego od wielu lat opalania się, należy zachować w tym umiar i chronić naszą skórę przed szkodliwymi skutkami promieniowania UV. Na rynku jest dostępnych wiele specyfików ochronnych: kremy, olejki, spraye. Wszystkie one muszą zawierać odpowiednie substancje, które powinny blokować szkodliwe promieniowanie, a jednocześnie być bezpieczne dla człowieka.
Przykładem substancji blokującej, czy raczej silnie pochłaniającej światło ultrafioletowe jest dibenzylidenoaceton. Synteza tej interesującej substancji nie jest skomplikowana i można ją przeprowadzić także w niezbyt bogato wyposażonej pracowni uczelnianej, szkolnej, a nawet amatorskiej. Doświadczenia, które można następnie przeprowadzić z wykorzystaniem dibenzylidenoacetonu są nie tylko pouczające, ale i efektowne. Myślę, że to zachęci Szanownego Czytelnika do podjęcia własnych eksperymentów.

Potrzebne substancje
Aby przeprowadzić odpowiednią syntezę potrzebujemy substancji z poniższej listy:
- aldehyd benzoesowy C7H6O,
- aceton C3H6O,
- wodorotlenek sodu NaOH.
Pierwsza substancja, czyli aldehyd benzoesowy - nazywany też benzaldehydem - jest organicznym związkiem chemicznym i najprostszym aldehydem aromatycznym (Rys.1).
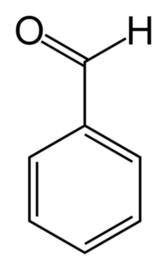
Aldehyd benzoesowy jest cieczą o charakterystycznym migdałowym zapachu i występuje naturalnie w owocach migdałowca pospolitego (śliwy migdał Prunus dulcis). Mimo, że wiele związków, np. cyjanowodór HCN i nitrobenzen C6H5NO2, posiadających ten zapach jest silnie toksycznych, to aldehyd benzoesowy nie wykazuje trujących właściwości. Posiada wiele zastosowań, tak w przemyśle chemicznym, jak i perfumiarskim, a także w gastronomii - wchodzi w skład oleju migdałowego, wykorzystywanego m.in. w produkcji marcepanu. Aldehyd ten stosunkowo łatwo się utlenia, nawet pod wpływem powietrza – powinien być przechowywany w szczelnie zamykanych naczyniach z ciemnego szkła. Świeżo otrzymany i czysty jest bezbarwny, ale żółknie z czasem. Starsze, mocniej już zabarwione próbki tej sybstancji przed wykorzystaniem w syntezie powinny zostać oczyszczone z produktów utleniania, np. poprzez destylację.
Z kolei aceton należy do klasy organicznych związków chemicznych nazywanych ketonami – jest najprostszym ketonem alifatycznym (Rys.2).
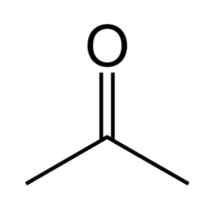
Aceton jest stosunkowo lotną cieczą i ma charakterystyczny ostry zapach – kojarzony często z zapachem zmywaczy lakieru do paznokci mimo faktu, że większość obecnie wykorzystywanych preparatów tego typu zawiera raczej octan etylu C4H8O2 zamiast opisywanego ketonu. Aceton obecny jest w niewielkich ilościach w krwi i moczu człowieka. Warto zauważyć, że w przypadkach zaawansowanej i nieleczonej cukrzycy jego zawartość w organizmie wyraźnie rośnie.
Zarówno aldehyd benzoesowy, jak i aceton nie są silnie toksyczne, ale mogą mieć negatywny wpływ na organizm przy odpowiednio dużej dawce pochłoniętej drogą pokarmową, wziewną lub inną. Obie substancje mogą mieć także działanie drażniące w stosunku do naszych tkanek – należy unikać bezpośredniego kontaktu ze skórą, oczami itp. Roztwory wodorotlenku sodu są silnymi zasadami i mogą powodować uszkodzenia ciała – szczególnie trzeba uważać na oczy. Aceton i alkohole (etylowy lub izopropylowy) są łatwopalne. Konieczne są odpowiednie środki ochrony osobistej.
Opisane substancje przedstawia Fot.1.
W samej syntezie jako rozpuszczalniki wykorzystać musimy dwie substancje: wodę H2O i alkohol etylowy C2H6O o stężeniu około 95% (spirytus, alkohol skażony).
Synteza
Opisana metoda syntezy nie jest oczywiście jedyną możliwą, ale sprawdziłem ją praktycznie i mogę ją polecić jako mało kłopotliwą i dającą dobre rezultaty [3].
Przystępując do właściwego etapu syntezy należy przygotować alkoholowy roztwór aldehydu benzoesowego poprzez rozpuszczenie 16cm3 tej substancji w 125cm3 etanolu. W ten sposób powinniśmy uzyskać bezbarwny (lub ledwo zauważalnie żółtawy) i klarowny roztwór. Ewentualne zmętnienie może być spowodowane zanieczyszczeniami. Z racji łatwości utleniania się aldehydu nie powinniśmy przygotowywać tego roztworu inaczej niż tylko bezpośrednio przed przeprowadzeniem dalszych czynności.
Osobno trzeba przygotować roztwór 9g wodorotlenku sodu w 75cm3 wody destylowanej. Proces rozpuszczania się tej substancji jest silnie egzotermiczny, przez co ciecz ulega ogrzaniu do stosunkowo wysokiej temperatury.
Ważne jest, żeby przed kolejnym etapem ochłodzić wszystkie roztwory do temperatury pokojowej, najlepiej poniżej 20°C – tyczy się to w szczególności zasady sodowej. Zwracam na to uwagę, ponieważ podczas reakcji, którą za chwilę uruchomimy wywiązują się pewne ilości energii na sposób ciepła, a wzrost temperatury mieszaniny reakcyjnej może mieć negatywny wpływ na wydajność procesu.
Alkoholowy roztwór aldehydu należy umieścić w odpowiednio dużej zlewce, najlepiej na mieszadle magnetycznym (Fot.2). W razie jego braku będzie konieczne energiczne mieszanie ręczne.
Teraz musimy postępować szybko. Do intensywnie mieszanego roztworu aldehydu należy wlać w jednej porcji przygotowany wcześniej schłodzony roztwór wodorotlenku sodu i po chwili przeznaczonej na wymieszanie roztworów (do kilku sekund) dodać 5cm3 acetonu.
Początkowo bezbarwny roztwór już po kilkunastu, kilkudziesięciu sekundach w wyniku zachodzącej reakcji powinien zmętnieć i zabarwić się na żółto, a potem na pomarańczowo (Fot.3).
Z moich obserwacji wynika, że w przypadku zastosowania acetonu o technicznej klasie czystości można czasem zaobserwować wystąpienie innego zabarwienia, ale jest to najczęściej przejściowe i nie wpływa znacząco na wynik syntezy. Powodem tego stanu rzeczy są najprawdopodobniej zanieczyszczenia występujące w acetonie wykorzystywanym jako rozpuszczalnik np. przy pracach malarskich. Inną przyczyną mogą być oczywiście zanieczyszczenia pozostałych odczynników wykorzystanych przy syntezie.
Warto monitorować temperaturę roztworu, tak by jej wartość zawierała się w zakresie 20-25°C – gdyby temperatura wzrosła powyżej tego zakresu trzeba schłodzić ciecz wraz z naczyniem np. w łaźni wodnej lub lodowej.
Po pewnym czasie można zauważyć powstanie dużych ilości żółtego osadu dibenzylidenoacetonu (Fot.4). Od czasu jego zauważenia należy prowadzić mieszanie jeszcze przez 30-60 minut, tak by substraty miały szansę przereagować w jak największym stopniu.
Po upływie przewidzianego czasu należy dodać do mieszaniny około 100cm3 wody destylowanej. Jest to konieczne, ponieważ jedynie część interesującego nas produktu wydzieliła się na tym etapie w postaci osadu. Duża ilość dibenzylidenoacetonu w dalszym ciągu występuje w postaci roztworu alkoholowego. Dodanie do roztworu wody drastycznie zmniejsza rozpuszczalność tej substancji, powodując wydzielenie dalszej porcji substancji stałej.
Po dokładnym wymieszaniu (i wyjęciu mieszadełka) możemy pozwolić na sedymentację osadu. Należy następnie przynajmniej kilkukrotnie przemyć go przez dekantację wodą, aż odczyn cieczy uzyska wartość zbliżoną do neutralnej, a następnie odsączyć. Jest to jednak czasochłonne i jeśli mamy tylko dostęp do odpowiedniego sprzętu to warto rozważyć inny sposób postępowania.
Zamiast przemywania przez dekantację i następnie sączenia grawitacyjnego bardziej wydajna okazała się metoda sączenia pod obniżonym ciśnieniem i przemywania osadu na sączku. Potrzebny do tego zestaw składa się z odpowiedniego lejka ze spiekiem szklanym (lejka Büchnera) osadzonego w korku zamykającym szczelnie kolbę ssawkową, czyli tzw. kolbę Büchnera (Fot.5). Spiek należy zabezpieczyć zwilżonym sączkiem o odpowiedniej średnicy, a kolbę poprzez odprowadzenie boczne i odpowiedni przewód podłączyć do źródła obniżonego ciśnienia np. w postaci pompki wodnej lub innej.
Mieszaninę poreakcyjną trzeba przenieść - w całości, jeśli objętość naczynia na to pozwoli, lub porcjami - do lejka (Fot.6). Następnym krokiem jest podłączenie źródła niskiego ciśnienia.
Po pierwszym odsączeniu osad pozostały na sączku trzeba zalać nową porcją wody destylowanej, delikatnie wymieszać bagietką i znowu odsączyć. Proces ten należy powtórzyć kilkakrotnie – tak długo aż przesącz uzyska pH zbliżone do neutralnego. Wtedy odsysanie powinniśmy pozostawić na nieco dłużej, np. do kilku minut. W ten sposób osad zostanie w dużej mierze osuszony (Fot.7).
Tak uzyskany produkt po przeniesieniu z lejka na arkusz papieru ma postać krystalicznego proszku o wyraźnie żółtej barwie (Fot.8).
Pozostałości wody należy usunąć poprzez suszenie w temperaturze pokojowej, najlepiej w eksykatorze.
Chociaż z punktu widzenia prostych doświadczeń czystość tak otrzymanego produktu jest wystarczająca, to najlepiej jest go oczyścić – tym bardziej, że nie wymaga to dużych nakładów pracy.
Oczyszczenie
Aby oczyścić otrzymany związek możemy zastosować stosunkowo prostą metodę, jaką jest rekrystalizacja. W tym celu surowy dibenzylidenoaceton powinniśmy rozpuścić na ciepło w jak najmniejszej ilości alkoholu etylowego lub innego - ja z powodzeniem wykorzystałem izopropanol. Trzeba jednak pamiętać, że alkohole są łatwopalne, więc ogrzewanie należy prowadzić bardzo ostrożnie na elektrycznej płycie grzewczej lub w inny sposób, jednak nigdy przy wykorzystaniu palnika z otwartym płomieniem.
Ilość alkoholu należy dobrać tak, by uzyskać roztwór nasycony produktu w podwyższonej temperaturze. Następnie trzeba odparować nieco alkoholu, po czym wyłączyć ogrzewanie i powoli ochłodzić klarowny, żółty płyn (Fot.9A).
Często już po kilku minutach można zauważyć formowanie się pierwszych igiełkowatych kryształów (Fot.9B). W niedługim czasie wykrystalizowuje duża ilość produktu (Fot.9C i D). Po schłodzeniu do temperatury pokojowej warto przenieść naczynie do lodówki na parę godzin (np. na noc), dzięki czemu odzyskamy jeszcze więcej dibenzylidenoacetonu.
Po zlaniu rozpuszczalnika możemy podziwiać pięknie wykształcone kryształy omawianej substancji - trzeba przyznać, że ich widok może być źródłem nie tylko dumy z przeprowadzonej syntezy, ale także miłych wrażeń natury estetycznej (Fot.10).
Kryształy wystarczy teraz przemyć niewielką ilością jak najzimniejszego alkoholu etylowego i wysuszyć. Oczyszczona w ten sposób substancja może być wykorzystana w wielu interesujących doświadczeniach. Warto ją przechowywać w szczelnie zamykanym naczyniu z brązowego szkła, oczywiście z opisem (Fot.11).
Doświadczenia
Aby przekonać się o interesujących właściwościach optycznych dibenzylidenoacetonu musimy przygotować jego roztwór w alkoholu etylowym. Stężenie substancji nie jest krytyczne, ale im jest ono większe, tym łatwiej będzie zaobserwować opisywane efekty. Najlepiej sporządzić roztwór zbliżony do nasyconego w temperaturze pokojowej. Taki roztwór jest przejrzysty i – w odróżnieniu od przygotowanego w celach porównawczych alkoholu bez dodatku dibenzylidenoacetonu (Fot.12A) – ma wyraźną żółtą barwę (Fot.12B). Roztwór jest dosyć trwały, jeśli przechowuje się go w szczelnie zamykanym naczyniu z ciemnego szkła, najlepiej w ciemności.
Naczynia z roztworami trzeba teraz ustawić na kartce białego papieru, np. używanego w drukarkach. Papier taki zawiera wybielacze optyczne, które bardzo silnie fluoryzują pod wpływem światła ultrafioletowego (UV). Pozwoli nam to na stwierdzenie jaką przepuszczalnością dla tego promieniowania cechują się oba roztwory. Na świetle widzialnym – zarówno w przypadku widoku z boku, jak i z góry – możemy zauważyć oczywiście różnicę w barwie, ale oba roztwory są przejrzyste (Fot.13 A i B). Możemy założyć więc, że przepuszczają one bez większych przeszkód większość światła widzialnego.
Po oświetleniu światłem UV możemy zobaczyć jednak inny widok (Fot.13C). Pod wpływem tego promieniowania biały papier rozbłyskuje jasnoniebieskim światłem powstałym na drodze fluorescencji. Roztwór alkoholu oczywiście sam w sobie nie fluoryzuje, ale możemy zaobserwować, że papier pod naczyniem świeci praktycznie tak samo jasno jak wokół. Zupełnie inaczej ma się sprawa z roztworem zawierającym dibenzylidenoaceton: płyn (szczególnie w widoku z góry) wydaje się być ciemny, prawie czarny. Papier pod naczyniem także praktycznie przestaje fluoryzować. Zjawisko to można zaobserwować nawet w przypadku cienkich, kilkumilimetrowych warstw roztworów (Fot.14).
Zaobserwowany efekt pozwala na stwierdzenie, że dibenzylidenoaceton rzeczywiście silnie pochłania światło UV. Można się o tym jednak przekonać także w inny sposób.
Poszukując odpowiedniej metody stwierdziłem, że bardzo dobrą okazją na zbadanie właściwości omawianej substancji jest wykorzystanie cyjanotypii, czyli techniki fotograficznej działającej w oparciu o światłoczułe związki żelaza, a nie srebra. W jednym z poprzednich numerów Chemii w Szkole opisałem sposób syntezy szczawianożelazianu potasu K3[Fe3(C2O4)3]·3H2O jako światłoczułego związku kompleksowego i jego wykorzystanie w szlachetnych technikach fotograficznych [4]. Pamiętać należy, że chociaż wykorzystywane w tym celu związki nie są silnie toksyczne, to mogą mieć negatywne działanie na organizm ludzki i być np. drażniące. Natomiast heksacyjanożelaziany w kontakcie z mocnymi kwasami mogą uwalniać toksyczny cyjanowodór.
Aby przygotować światłoczuły papier należy sporządzić wodny roztwór równych ilości wspomnianego szczawianożelazianu i heksacynajożelazianu(III) potasu K3[Fe(CN)6] – stężenie roztworu powinno wynieść do kilku procent i należy je dobrać doświadczalnie. Takim roztworem trzeba następnie nasączyć np. sączki bibułowe i pozostawić do wyschnięcia. Oczywiście przygotowanie roztworu, jak i impregnację oraz suszenie sączków należy prowadzić w ciemności lub przy świetle pomarańczowej (czerwonej) lampy ciemniowej, tak aby uniknąć przedwczesnego naświetlenia. Przygotowany w ten sposób krążek światłoczułego papieru ma barwę zieloną (Fot.15).
Papier światłoczuły przykryto następnie płytką szklaną (wykorzystaną dużą szalkę Petriego), na którą naklejono krzyżujące się pod kątem prostym paski czarnej taśmy samoprzylepnej. W ten sposób podzielono znajdujący się pod spodem papier światłoczuły na cztery sektory (Fot.16). Dzięki temu wykorzystując jeden krążek bibuły możemy sprawdzić działanie światła UV w różnych warunkach, ponieważ na powierzchnię szkła zostały naniesione zróżnicowane substancje:
- sektor 1 – brak pokrycia (kontrola),
- sektor 2 – szkło pokryte roztworem etanolu z dodatkiem kilku kropli gliceryny,
- sektor 3 – szkło pokryte etanolowym roztworem dibenzylidenoacetonu z dodatkiem kilku kropli gliceryny,
- sektor 4 – szkło pokryte kremem przeciwsłonecznym.
Dodatek gliceryny w roztworach ma za zadanie spowolnienie wysychania. Jeśli naświetlanie ma trwać dłużej, warto co jakiś czas nanosić ponownie substancje na sektory 2 i 3. W przypadku sektora 4 wykorzystano przejrzysty – przynajmniej dla naszych oczu - krem przeciwsłoneczny o deklarowanym przez producenta wskaźniku ochrony przeciwsłonecznej SPF (ang. sun protection factor) równym 30. Przy takiej wartości wskaźnika krem powinien zatrzymać około 97% promieniowania z zakresu UV-B [5].
Tak przygotowany zestaw należy wystawić na bezpośrednie działanie promieni słonecznych i naświetlać kilka minut. Można oczywiście zastosować także naświetlanie światłem sztucznym, ale wtedy zwykle trzeba wydłużyć czas ekspozycji. Naświetlanie przerywamy w momencie, kiedy kontrolny sektor 1 nabierze wyraźnie niebieskiej barwy. Trzeba rozmontować wtedy zestaw, a papier delikatnie wypłukać w chłodnej, bieżącej wodzie tak, by usunąć z niego nieprzereagowane substancje, a następnie wysuszyć. Uzyskany efekt przedstawia Fot.17.
Jak widać, zarówno samo szkło (sektor 1), jak i roztwór alkoholu (sektor 2) nie ochronił papieru przed naświetleniem, czego oznaką jest wytworzenie niebieskiego barwnika (błękitu pruskiego) na powierzchni papieru, a właściwie także i w jego strukturze [6]. Proces ten przebiega szczególnie efektywnie w wyniku naświetlenia wysokoenergetycznym światłem UV. Miejsca zakryte taśmą nie wykazują żadnego zabarwienia. Ciekawe jest jednak, że sektory potraktowane roztworem dibenzylidenoacetonu (sektor 3) i kremu przeciwsłonecznego (sektor 4) mimo że dla ludzkiego oka wydawały się przejrzyste, to uległy naświetleniu w znikomym tylko stopniu. Roztwór uzyskanej przez nas substancji wykazał się w tych warunkach prawie tak dobrymi właściwościami blokowania światła UV jak produkt fabryczny.
O opisanych właściwościach można się też przekonać w inny, dużo prostszy sposób. Odrobinę roztworu dibenzylidenoacetonu wystarczy nanieść na fluoryzujący papier, a następnie wysuszyć (Fot.18). Powstała plama jest delikatnie żółtawa i w naturalnym świetle prawie niewidoczna.
Po oświetleniu światłem UV możemy oczywiście zobaczyć ciemną plamę na tle jasnoniebieskiej fluorescencji papieru (Fot.19).
Możemy zaobserwować kolejny interesujący fakt. W tym celu trzeba zakryć część plamy czarnym papierem i oświetlić całość światłem ultrafioletowym (Fot.20A).
Wyjaśnienie
Opisana synteza jest przykładem kondensacji aldolowej. Jest to reakcja chemiczna powstawania aldoli (aldehydoalkoholi - aldehydów, w których strukturze występuje grupa hydroksylowa) z dwóch substratów, z których jeden musi posiadać przynajmniej jeden atom wodoru przy atomie węgla α, czyli atomie bezpośrednio związanym z grupą −CHO. Powstają przy tym 3-aldole, ponieważ grupa hydroksylowa znajduje się przy trzecim atomie węgla, jeśli liczyć od grupy aldehydowej. Środowisko reakcji ustala się zwykle jako zasadowe. Substratami kondensacji aldolowej mogą być dwa aldehydy, dwa ketony lub aldehyd i keton. Ketony zwykle cechują się w tym przypadku niższą reaktywnością [7].
Kondensacja aldolowa może także zachodzić pomiędzy cząsteczkami tego samego reagentu. W takim przypadku otrzymalibyśmy mieszaninę produktów. Można tego uniknąć stosując jako jeden z substratów związek nieposiadający wodoru przy atomie węgla α (np. aldehyd benzoesowy) i dobierając odpowiednio warunki reakcji.
Wyjaśnijmy jeszcze, dlaczego po zmieszaniu roztworów aldehydu benzoesowego i wodorotlenku sodu musieliśmy się śpieszyć, aby dodać aceton. Otóż po zalkalizowaniu środowiska dodatkiem wodorotlenku sodu rozpoczyna się tzw. reakcja Cannizarro, polegająca na dysproporcjonowaniu aldehydu do odpowiedniego alkoholu i kwasu karboksylowego – w tym przypadku do alkoholu benzylowego C7H8O i kwasu benzoesowego C7H6O2 [8]. Gdyby aceton został dodany po dłuższym czasie, mogłoby to spowodować zużycie części aldehydu i wyraźny spadek wydajności reakcji tworzenia dibenzylidenoacetonu.
W naszym przypadku główną reakcję między aldehydem benzoesowym i acetonem w środowisku roztworu wodno-alkoholowego o odczynie zasadowym (NaOH) można opisać równaniem:
Powstający dibenzylidenoaceton teoretycznie może występować w postaci trzech izomerów. W warunkach reakcji powstaje głównie izomer trans-trans, jako znacznie stabilniejszy od izomerów cis-cis i cis-trans (Rys.3).
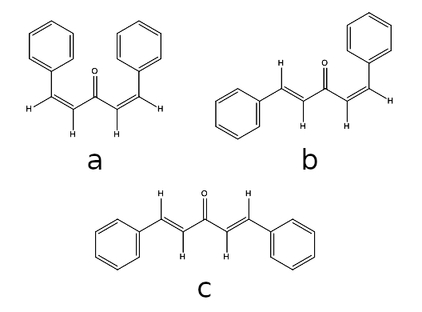
Wydajność syntezy wyniosła w moim przypadku około 75% teoretycznej, co wydaje się dosyć dobrym rezultatem. Z danych literaturowych wynika, że stosując odpowiednie metody można uzyskać wydajności na poziomie 80% a nawet wyższe [9].
Dibenzylidenoaceton, jak już się przekonaliśmy, jest w normalnych warunkach żółtym, krystalicznym ciałem stałym. Rozpuszcza się dosyć dobrze w alkoholach, zaś w wodzie jest praktycznie nierozpuszczalny. Poza opisanymi w tym artykule właściwościami ochronnymi jest też wykorzystywany jako ligand w chemii związków metaloorganicznych.
Każda cząsteczka może pochłonąć promieniowanie elektromagnetyczne o odpowiedniej długości zależnej od budowy związku. Pochłonięta energia oczywiście nie może zniknąć bezpowrotnie, lecz zostaje przekształcona w inne jej formy. W przypadku fosforescencji część pochłoniętej energii zostaje zwrócona do środowiska w postaci promieniowania elektromagnetycznego o większej długości (przesunięcie Stokesa), co mogliśmy zaobserwować np. w postaci świecenia pod wpływem światła UV papieru poddanego procesowi wybielania chemicznego.
W przypadku dibenzylidenoacetonu większość energii pochłoniętego światła UV zostaje natomiast rozproszona w postaci cieplnych drgań cząsteczek.
Warto zauważyć, że żółta barwa roztworu tego związku chemicznego świadczy, że pochłania on silnie nie tylko niewidoczny dla naszych oczu ultrafiolet (w takim przypadku roztwór powinien być bezbarwny), ale także w mniejszym stopniu światło widzialne o barwach z niebieskiego krańca widma.
Światło ultrafioletowe niesie ze sobą większą energię (mniejsza długość fali) niż światło widzialne. Z tego powodu wiele związków światłoczułych jest bardziej wrażliwych na ten rodzaj promieniowania, co ujawniło doświadczenie z cyjanotypią. Potwierdziło ono także, że już cienka warstwa roztworu dibenzylidenoacetonu ma dobre właściwości blokujące ultrafiolet, porównywalne z komercyjnymi środkami.
Niestety fakt, że dibenzylidenoaceton tak silnie pochłania światło UV powoduje też, że związek ten jest niestabilny po wystawieniu na takie promieniowanie. Wzbudzone cząsteczki tej substancji stają się na tyle reaktywne, że ulegają reakcjom cykloaddycji tworząc mieszaninę różnorodnych produktów. Właśnie z tego powodu po dłuższym czasie ekspozycji na UV stopień pochłaniania promieniowania spada (vide Fot.20). Podobnie rzecz się ma z wieloma substancjami zabezpieczającymi przed negatywnym – m.in. mutagennym i rakotwórczym – działaniem silnego światła słonecznego zawierającego promieniowanie z zakresu UV. Z tego powodu wykorzystując kremy przeciwsłoneczne trzeba w odpowiednich odstępach czasu nakładać na skórę nową ich warstwę. Dzisiaj stosowane kremy zawierają też oczywiście inne dodatkowe składniki wspomagające ochronę przed UV.
Literatura:
- [1] Wojtusiak R., Rozróżnianie barw u zwierząt a barwy kwiatów, Kosmos B, 62, 1936, str. 259-284 powrót
- [2] Skórska E., Oddziaływanie słonecznego promieniowania ultrafioletowego na organizm człowieka, KOSMOS. Problemy Nauk Biologicznych, 65 (4), 2016, str. 657-667 powrót
- [3] Making Sunscreen, w serwisie: https://www.youtube.com/, dostępne online: https://www.youtube.com/watch?v=gavq_sZZ8B0 [dostęp: 27.07.2019] powrót
- [4] Ples M., Światłoczułe związki w fotografii, Chemia w Szkole, 1 (2018), Agencja AS Józef Szewczyk, str. 35-41 powrót
- [5] Wskaźnik ochrony przeciwsłonecznej, w serwisie: https://pl.wikipedia.org/, dostępne online: https://pl.wikipedia.org/wiki/Wska%C5%BAnik_ochrony_przeciws%C5%82onecznej [dostęp: 27.07.2019] powrót
- [6] Stulik D. C., Kaplan A., Cyanotype, w: The Atlas of Analytical Signatures of Photographic Processes, dostępne online: http://www.getty.edu/conservation/publications_resources/pdf_publications/pdf/atlas_cyanotype.pdf [dostęp: 27.07.2019] powrót
- [7] Morrison R., Boyd R., Chemia organiczna (tom 1), wyd. II, Wydawnictwo naukowe PWN, 1990r., str. 804 powrót
- [8] Cannizzaro S., Ueber den der Benzoësäure entsprechenden Alkohol, Liebigs Annalen, 88, 1853, str. 129-130 powrót
- [9] Conard Ch. R., Dolliver M. A., Dibenzalacetone, Organic Syntheses, 12, 1932, str. 22 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples



















