Fotosynteza w probówce
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (6/2018):

Fotosyntezę można zdefiniować jako proces umożliwiający wytworzenie związków organicznych z materii nieorganicznej. Zachodzi ona przy udziale światła w komórkach zawierających chlorofil lub bakteriochlorofil [1].
Wśród znanych nam procesów biochemicznych fotosynteza zajmuje jedno z najważniejszych miejsc i to nie tylko z akademickiego punktu widzenia. Zauważmy, że prawie cała energia, którą dysponują organizmy żywe, pochodzi - bezpośrednio lub pośrednio - ze Słońca i dociera do nas w dużej mierze jako promieniowanie elektromagnetyczne z zakresu widzialnego. Fotosynteza pozwala więc organizmom autotroficznym na przekształcenie światła w postać energii wiązań chemicznych związków organicznych, która jest następnie wykorzystywana przez nie same, a także przez organizmy heterotroficzne. W ten sposób przy rozpatrywaniu Ziemi jako całości wzrasta masa materii organicznej. Dzieje się to oczywiście kosztem materii nieorganicznej. Wysoka koncentracja tlenu w atmosferze naszej planety także jest skutkiem milionów lat prowadzenia fotosyntezy przez zróżnicowane organizmy.
Trzeba zaznaczyć, że istnieje także starszy ewolucyjnie mechanizm autotrofii, obywający się bez energii światła słonecznego. Jest to chemosynteza, w której energia zostaje wytworzona na drodze utleniania prostych związków nieorganicznych lub metanu [2]. Chemoautotrofami są pewne bakterie, np. nitryfikacyjne z rodzajów Nitrosomonas czy Nitrobacter, siarkowe Beggiatoa, żelazowe Leptospirillum, wodorowe Hydrogenobacter i inne [3]. Organizmy chemoautotroficzne pełnią ważną rolę w obiegu pierwiastków takich jak azot i fosfor. Z punktu widzenia produkcji biomasy rola tego rodzaju przemian metabolicznych jest jednak mniejsza niż fotostyntezy.
W niniejszym artykule zajmiemy się głównie fotosyntezą u organizmów eukariotycznych, tj. takich, których komórki zawierają wyspecjalizowane organelle. U tych organizmów (np. roślin zielonych Chloroplastida) proces fotosyntezy zachodzi w odpowiednich strukturach - są to chloroplasty zawierające barwniki barwniki fotosyntetyczne, głównie chlorofile. U roślin chloroplasty występują najliczniej w komórkach liści, które są głównymi organami prowadzącymi asymilację dwutlenku węgla. Mniejszą ilość chloroplastów zawierają także inne niezdrewniałe tkanki.
Fotosynteza jest oczywiście bardzo skomplikowanym procesem, ale pewne jej mechanizmy możemy zbadać nawet niewielkim nakładem środków i czasu. Jednym z pomocnych po temu środków jest tak zwana reakcja Hilla, biorąca swą nazwę od imienia Roberta Hilla, brytyjskiego biochemika, który w 1939 roku opisał wspomnianą reakcję [4]. Pozwala ona na przeprowadzenie fotosyntezy in vitro, w izolowanych chloroplastach.
Możemy wykonać dwie wariacje na temat reakcji Hilla. Pierwsza z nich jest bardziej efektowna, ale będzie wymagać nieco trudniejszych do zdobycia substancji. Druga natomiast da się przeprowadzić przy wykorzystaniu stosunkowo łatwo dostępnych związków chemicznych.
Izolacja chloroplastów
Aby przeprowadzić doświadczenie musimy zaopatrzyć się w chloroplasty. W tym celu nadają się jakiekolwiek zielone, niezbyt twarde części roślin, a w szczególności liście. Odpowiednie są świeże liście szpinaku warzywnego Spinacia oleracea z rodziny szarłatowatych Amaranthaceae. Roślina ta jest ceniona jako bardzo bogate źródło witamin i białka, a także błonnika, karotenoidów oraz soli mineralnych. Ważną zaletą szpinaku są niewielkie koszty uprawy i - co szczególnie ważne także dla nas jako eksperymentatorów - jego dostępność przez cały rok, także w czasie niedoboru świeżych roślin jadalnych [5].
Do doświadczenia wystarczy niewielka ilość (kilka, kilkanaście) liści szpinaku (Fot.1). Inaczej niż w przypadku np. ekstrakcji chlorofili nie może być to szpinak mrożony, a jedynie świeży [6].
Muszę uprzedzić Czytelników, że dla osiągnięcia najlepszego efektu wszystkie czynności izolacyjne w stosunku do chloroplastów należy prowadzić w ciemności lub przy jak najsłabszym świetle. Także gotowy izolat powinien być przechowywany w warunkach braku oświetlenia. Ma to na celu ochronę chloroplastów przed uszkodzeniem.
Liście trzeba pociąć na niewielkie fragmenty, umieścić je w schłodzonym porcelanowym moździerzu i dodać nieco czystego piasku kwarcowego (ewentualnie drobnego i dokładnie oczyszczonego zwykłego piasku), co można zobaczyć na Fot.2.
Chloroplasty pozyskuje się w środowisku odpowiedniego roztworu izolacyjnego, którego rolą jest ochrona delikatnych organelli przed uszkodzeniem. Do jego przygotowania potrzebujemy substancji z poniższej listy:
- sacharoza C12H22O11
- chlorek potasu KCl
- roztwór buforowy (fosforanowy, pH 7)
Nie wykorzystujemy tutaj żadnych silnie toksycznych substancji, ale należy zachować ostrożność jak zawsze przy pracy z chemikaliami. Dotyczy to także każdej substancji wykorzystywanej w dalszych etapach doświadczeń opisywanych w tym artykule.
Do przygotowania wszystkich potrzebnych roztworów należy zastosować wodę destylowaną.
Bufor fosforanowy można uzyskać odważając 5,026g wodorofosforanu sodu Na2HPO4 i 2,878g diwodorofosforanu sodu NaH2PO4, a następnie rozpuszczając je w wodzie, tak by ostateczna objętość roztworu wyniosła 1dm3 [7]. Oczywiście najlepiej jest skontrolować pH roztworu i ewentualnie skorygować ilości substancji wchodzących w jego skład albo dodać nieco zasady lub kwasu, tak by odczyn był jak najbliższy przytoczonej wartości.
Następnie, aby przygotować właściwy roztwór izolacyjny musimy odważyć 136,92g sacharozy i 0,75g chlorku potasu, a następnie obie substancje rozpuścić w otrzymanym uprzednio buforze fosforanowym, tak aby końcowa objętość ponownie była równa 1dm3. Roztwór można przechowywać przez pewien czas w szczelnie zamkniętym naczyniu w lodówce.
Przygotowane, uprzednio pofragmentowane liście szpinaku wraz z piaskiem należy zalać w moździerzu kilkunastoma centymetrami sześciennymi schłodzonego roztworu izolacyjnego, a następnie ucierać (Fot.3).
Piasek ułatwia zniszczenie komórek (w szczególności ich ścian komórkowych) i wydostanie się na zewnątrz chloroplastów. Ucierania nie należy prowadzić zbyt długo. Ciągle chłodną mieszaninę trzeba następnie przesączyć przez gazę, co powinno zatrzymać większe fragmenty komórek. Do przesączu przedostają się między innymi chloroplasty, które dzięki odpowiedniemu środowisku zapewnianemu przez roztwór izolacyjny nie ulegają natychmiastowemu uszkodzeniu.
Powstałą ciecz należy schłodzić np. w łaźni wodnej z dodatkiem lodu (Fot.4). Zielona zawiesina chloroplastów do czasu dalszych czynności powinna być przechowywana w warunkach braku oświetlenia w lodówce.
W razie istnienia takiej możliwości zawiesinę chloroplastów można zagęścić poprzez wirowanie i zawieszenie uzyskanego osadu w nowym buforze izolacyjnym.
Zawiesiny chloroplastów nie można zbyt długo przechowywać, dlatego do następnych doświadczeń najlepiej przejść natychmiast albo krótko po izolacji.
Sztuczna fotosynteza – wersja I
W tym doświadczeniu wykorzystamy 2,6-dichlorofenoloindofenol C12H7NCl2O2 (Rys.1).
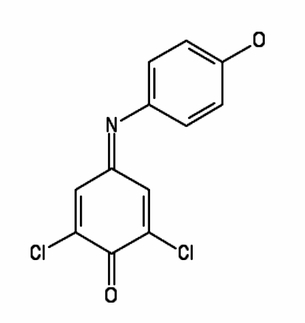
Związek jest używany jako kolorowy wskaźnik redoks. Jego forma utleniona ma barwę niebieską, zaś zredukowana jest bezbarwna. Substancja ta bywa także używana do określania koncentracji kwasu askorbinowego C26H8O6 (witaminy C) w osoczu [8].
Aby przeprowadzić doświadczenie należy do dwóch probówek lub innych naczyń wprowadzić po 5,8cm3 zawiesiny chloroplastów i dodać do każdej z nich 0,2cm3 0,1% roztworu 2,6-dichlorofenoloindofenolu w takim samym buforze fosforanowym, jakiego użyliśmy do przygotowania roztworu izolacyjnego. W razie zbyt dużej koncentracji chloroplastów należy poeksperymentować z rozcieńczeniem zawiesiny.
Obie próbki na tym etapie mają barwę ciemnoniebieską (Fot.5).
Jedną z probówek następnie wystawiamy na światło. Najlepsze w tym celu jest światło słoneczne, ale w razie potrzeby można je zastąpić sztucznym. Ważne jest jednak, by w takim wypadku żarówka nie ogrzewała zbytnio układu reakcyjnego. Druga probówka powinna natomiast zostać dokładnie zabezpieczona przed światłem – np. przez owinięcie spożywczą folią aluminiową.
Obserwację próbki wystawionej na światło słoneczne warto prowadzić w czasie rzeczywistym. Efekt przedstawia Fot.6.
Jak widać, po ekspozycji na światło dosyć szybko doszło do całkowitego zaniku niebieskiej barwy 2,6-dichlorofenoloindofenolu, dzięki czemu ponownie można obserwować zielony kolor chlorofilu zawartego w chloroplastach.
Po zaniku barwy próbki naświetlanej należy ją porównać z drugą, pozostawioną w ciemności (Fot.7).
Możemy zaobserwować, że odbarwieniu uległa jedynie ta próbka, która była wystawiona na działanie promieni słonecznych. Uprawniony jest więc wniosek, że do zmiany barwy dochodzi tutaj w reakcji na światło.
Przedstawiona reakcja jest ciekawa, a jej efekt wyraźnie dostrzegalny. Zdaję sobie jednak sprawę, że wykorzystany w niej wskaźnik redoks może być trudny do zdobycia, dlatego poniżej przedstawiam uproszczoną wersję z wykorzystaniem bardziej dostępnych substancji.
Sztuczna fotosynteza - wersja II
W tym przypadku zamiast 2,6-dichlorofenoloindofenolu zastosujemy heksacyjanożelazian(III) potasu K3[Fe(CN)6]. Jest to związek kompleksowy, więc wchodzący w jego skład anion składa się z żelaza(III) Fe3+ wraz z sześcioma grupami cyjankowymi CN-. Strukturę tego anionu przedstawia Rys.2.
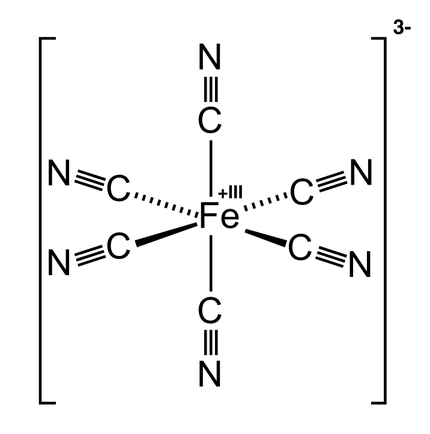
Patrząc jedynie na wzory chemiczne omawiany związek jest łatwo pomylić z heksacyjanożelazianem(II) potasu K4[Fe(CN)6]. Na szczęscie obie substancje można rozróżnić gołym okiem, ponieważ o ile heksacyjanożelazian(II) ma barwę żółtą, to potrzebny nam heksacyjanożelazian(III) tworzy kryształy o pięknej czerwonej barwie (Fot.8).
Tutaj ostrzeżenie: sam heksacyjanożelazian(III) nie jest toksyczny, ale w kontakcie tej substancji z kwasami może dochodzić do wydzielania silnie trujących gazów, np. cyjanowodoru HCN! Trzeba o tym pamiętać także przy sprzątaniu po doświadczeniu.
Potrzebny nam jest bardzo silnie rozcieńczony roztwór omówionej powyżej soli. Do 100cm3 wody wystarczy dodać dosłownie kilka kryształków heksacyjanożelazianu(III) wielkości ziarenek maku by uzyskać wymagane stężenie. Taki roztwór ma barwę żółto-pomarańczową (Fot.9).
Dalej postępujemy podobnie jak w poprzedniej wersji doświadczenia, tj. do dwóch probówek przenosimy po kilka centymetrów sześciennych zawiesiny chloroplastów, a następnie dodajemy niewielką objętość roztworu heksacyjanożelazianu(III) i mieszamy. Jedną z probówek umieszczamy w ciemności (np. przez owinięcie folią aluminiową), zaś drugą na świetle (Fot.10).
Zauważmy, że silnie rozcieńczony roztwór soli nie wpłynął w żaden sposób na barwę próbki.
Efekt doświadczenia można zobaczyć na Fot.11. Na światło wystawiono także kontrolną próbkę zawiesiny chlorofilu nie zawierającą dodatku soli kompleksowej – w jej przypadku nawet po kilku godzinach naświetlania nie zauważono większych zmian (Fot.11A). Czasem jednak w tym przypadku udaje się zaobserwować niewielką ilość powstających pęcherzyków gazu.
Próbki zawierające sól kompleksową mają nieco inny wygląd. W obu doszło do normalnego w tym przypadku wytrącenia kłaczkowatego osadu zawierającego wyizolowane chloroplasty – zjawisko to może być spowodowane wykorzystaniem zbyt stężonego roztworu buforowego, ale zwykle nie przeszkadza w obserwacjach (w razie potrzeby warto doświadczalnie dobrać stężenia roztworów). W próbce naświetlanej już po kilku, kilkunastu minutach można zaobserwować wydzielanie sporych ilości jakiegoś gazu – formuje on łatwe do zauważenia pęcherzyki (Fot.11B). Natomiast próbka przechowywana w ciemności nie wykazuje jakichkolwiek oznak wydzielania się gazu (Fot.11C).
Zatykając probówkę B korkiem z elastyczną rurką można zebrać powstający gaz, najlepiej poprzez wypieranie wody z kolejnej probówki. Próba z tlącym się łuczywkiem pozwala na identyfikację – drewno rozpala się jasno, możemy więc stwierdzić, że badanym gazem jest tlen.
Wyjaśnienie
Chloroplasty jako organelle autonomiczne są otoczone dwiema błonami, osłaniającymi stromę wypełniającą ich wnętrze. Posiadają też własny materiał genetyczny w formie zamkniętej kolistej nici. Błona zewnętrzna dobrze przepuszcza jony. Wewnętrzna natomiast jest słabo przepuszczalna i tworzy liczne struktury nazywane tylakoidami, które są ułożone w płaskie stosy (tylakoidy gran).
Fotosyntezę można podzielić na dwa etapy: fazę jasną i ciemną.
Faza jasna zachodzi w błonach tylakoidów i jak sama nazwa wskazuje wymaga dostępu światła. Ma ona na celu przekształcenie energii promienistej światła widzialnego w formę energii wiązań związków chemicznych: adenozyno-5′-trifosforanu C10H16N5O13P3 (ATP) i zredukowanego estru fosforanowego dinukleotydu nikotynoamidoadeninowego C21H27N7O14P2 (NADPH).
Energia światła wykorzystywana jest do przenoszenia elektronów oderwanych od cząsteczki wody. Kompleks enzymatyczny rozkładający wodę (ang. Oxygen Evolving Complex, OEC) zawiera w swojej strukturze jony manganu oraz wapnia. Pozyskane w ten sposób elektrony są następnie transportowane przez wieloetapowy system specjalizowanych przenośników na będącą ich ostatecznym akceptorem utlenioną formę formę NADP+. W efekcie powstaje cząsteczka NADPH. W transporcie elektronów biorą udział trwale związane z błoną kompleksy białkowo-lipidowo-barwnikowe: fotoukład I (PS I, działający z maksymalną wydajnością przy długości fali równej 700nm), fotoukład II (PS II, maksymalna wydajność przy 680nm) i kompleks cytochromowy b6f. Wymagane są także ruchliwe przekaźniki elektronów: plastochinon C53H80O2 i niewielkie, zawierające w swej strukturze miedź białko plastocyjanina.
Przedstawione tutaj procesy prowadzą jednocześnie do wytworzenia transbłonowego gradientu stężenia jonów wodorowych, co jest wykorzystywane jako siła napędowa dla enzymu syntazy ATP, wytwarzającej ten związek z cząsteczek adenozyno-5′-difosforanu C10H15N5O10P2 (ADP) i reszt fosforanowych.
Właściwą rolę barwników fotosyntetycznych pełnią oczywiście związki z grupy chlorofili. Ich zdolność do ulegania wzbudzeniu w wyniku aktu pochłonięcia energii świetlnej można łatwo zademonstrować oświetlając acetonowy wyciąg chlorofili światłem o wysokiej energii, np. ultrafioletowym. Energia wzbudzenia jest wtedy oddawana do środowiska w postaci światła o pięknej czerwonej barwie (Fot.12).
Faza ciemna fotosyntezy nie wymaga obecności światła. Jest ona nazywana też cyklem Calvina-Bensona i zachodzi w stromie chloroplastów. Energia zgromadzona w postaci puli cząsteczek wysokoenergetycznych związków chemicznych ATP i NADPH jest wykorzystywana do przekształcenia dwutlenku węgla CO2 do prostych związków organicznych. Następuje to poprzez przyłączenie dwutlenku do rybulozo-1,5-bisfosforanu C5H12O11P2. W toku dalszych przemian powstaje aldehyd 3-fosfoglicerynowy C3H7O6P , a następnie glukoza będąca ostatecznym produktem. Jednocześnie odtwarzany jest rybulozo-1,5-bisfosforan konieczny do związania kolejnych cząsteczek dwutlenku węgla i zamknięcia cyklu [9].
Zauważmy, że faza jasna fotosyntezy nie mogłaby zachodzić w razie braku obecności ostatecznego akceptora elektronów odrywanych od wody. W warunkach fizjologicznych rolę tę pełni NADP, ulegając tym samym redukcji do NADPH.
W reakcji Hilla wyizolowane chloroplasty prowadzą fotosyntezę w obecności sztucznego akceptora elektronów, jakim jest np. 2,6-dichlorofenoloindofenol. W takim przypadku przeniesienie na jego cząsteczki elektronów (a więc redukcja) powoduje zanik barwy roztworu. Mamy więc do czynienia z wieloetapową reakcją redoks, której niektóre kroki zachodzą dzięki dostarczeniu energii na sposób światła.
W przypadku drugiej wersji doświadczenia sztucznym akceptorem elektronów jest kompleksowy jon heksacyjanożelazianowy(III) [Fe(CN)6]3-, który ulega redukcji do heksacyjanożelazianowego(II) [Fe(CN)6]4-. Co prawda nie mogliśmy tutaj zauważyć żadnej zmiany barwy, ale pamiętajmy skąd pochodzą przenoszone elektrony. Są one odrywane od wody, czego skutkiem ubocznym jest powstawanie cząsteczek tlenu O2, co zostało przez nas zaobserwowane [10].
Reakcja Hilla dowodzi, że tlen uwalniany w procesie fotosyntezy nie pochodzi z asymilowanego dwutlenku węgla, lecz z rozkładanej wody, ponieważ odbarwienie 2,6-dichlorofenoloindofenolu zachodzi nawet w razie całkowitego braku dwutlenku węgla w układzie. Chloroplasty są więc w takich warunkach dalej zdolne do rozkładu wody, uwalniania tlenu i redukcji naturalnych lub sztucznych akceptorów elektronów, ale nie do wytwarzania glukozy.
W ten stosunkowo prosty sposób udało nam się wniknąć w molekularne podstawy tak ważnego dla życia procesu, jakim jest fotosynteza.
Literatura:
- [1] Bryant D. A., Frigaard N. U., Prokaryotic photosynthesis and phototrophy illuminated, Trends in Microbiology, 11(14), 2006, str. 488-496 powrót
- [2] Kunicki-Goldfinger W., Życie bakterii, Wydawnictwo Naukowe PWN, Warszawa, 2005, str. 206-213 powrót
- [3] Leptospirillum, w serwisie: https://microbewiki.kenyon.edu, dostępne online: https://microbewiki.kenyon.edu/index.php/Leptospirillum, [dostęp 08.10.2018] powrót
- [4] Hill R., Oxygen Evolved by Isolated Chloroplasts, Nature, 139 (3525), 1937, str. 881-882 powrót
- [5] Doruchowski R. W., Warzywa liściowe, Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa, 1966, str. 138-179 powrót
- [6] Ples M., Niezwykłe barwy. O barwnikach roślinnych, Biologia w Szkole, 2 (2016), Forum Media Polska Sp. z o.o., str. 60-63 powrót
- [7] Buffers in Molecular Biology, w serwisie: http://serge.engi.tripod.com/, dostępne online: http://serge.engi.tripod.com/MolBio/Buffer_cal.html, [dostęp 08.10.2018] powrót
- [8] VanderJagt D. J., Garry P. J, Hunt W. C., Ascorbate in plasma as measured by liquid chromatography and by dichlorophenolindophenol colorimetry, Clinical Chemistry, 32 (6), 1986, str. 1004-1006 powrót
- [9] Kopcewicz J., Lewak S., Gabryś H., Fizjologia roślin, Wydawnictwo Naukowe PWN, Warszawa, 2005 powrót
- [10] Krogmann D. W., Jagendorf A. T., Comparison of Ferricyanide and 2,3',6-Trichlorophenol Indophenol as Hill Reaction Oxidants, Plant Physiology, 34(3), 1959, str. 277-282 powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples











