Świecąca blaszka - katalizator miedziowy
Kataliza kontaktowa
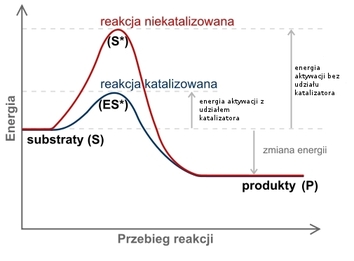
Katalizator jest substancją chemiczną, która dodana do układu reakcyjnego obniża energię aktywacji reakcji chemicznej, czego efektem jest wzrost szybkości reakcji chemicznej. Energia aktywacji jest z kolei najmniejszą ilością energii, jaką musi posiadać układ reakcyjny, by reakcja mogła w ogóle zajść. Ilustruje to poniższy wykres:
O katalizatorach mówiliśmy już w przypadku wykrywania amylazy.
Katalizator uczestniczy w reakcji chemicznej, ale nie ulega trwałej przemianie chemicznej. Substancja taka wpływa na przebieg reakcji zmieniając jej mechanizm. Działanie katalizatora opiera się na powstawaniu w reakcji z substratem przejściowego nietrwałego związku chemicznego, który reaguje dalej z wytworzeniem produktu końcowego i odtworzeniem wyjściowego katalizatora. W ten sposób reakcja przebiega szybciej niż bez użycia katalizatora.
Katalizatory dzieli się zwykle ze względu na fazę w jakiej one występują podczas reakcji:
- katalizatory homogeniczne - takie, które występują w tej samej fazie, co reagenty (np. rozpuszczone w roztworze reakcyjnym),
- katalizatory heterogeniczne - takie, które tworzą odrębną fazę.
Do drugiej kategorii należą między innymi katalizatory kontaktowe, gdzie reakcja zachodzi na powierzchni stałego katalizatoa, zaś reagenty występują w fazie ciekłej lub gazowej. Używając powszechnie dostępnych materiałów możemy przeprowadzić przykładową reakcję tego typu. Dodatkową zachętą może być interesujący efekt wizualny.
Potrzebne materiały
Tak jak obiecałem, potrzebujemy jedynie dwóch łatwo dostępnych substancji:
- aceton C3H6O,
- miedź Cu, cienka blacha
Ostrzeżenie: Aceton nie jest toksyczny, jednak długotrwałe wdychanie jego par może powodować ból i zawroty głowy, a w większych ilościach zatrucia. Aceton jest bardzo lotny i łatwopalny; należy zachować ostrożność wobec źródeł zapłonu. Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Aceton można oczywiście kupić w sklepie chemicznym, ale można go z łatwością nabyć w sklepach z farbami i rozpuszczalnikami, jest on też składnikiem niektórych zmywaczy lakieru do paznokci. Blaszka miedziana powinna być jak najcieńsza, o powierzchni kilku centymetrów kwadratowych. W razie braku takiej blachy można ją zastąpić rozklepanym drutem miedzianym, lub nawet zwitkiem jak najcieńszego drutu wykonanego z tego metalu.
W blaszce należy wywiercić niewielki otwór i zawiesić ją na kawałku cieńkiego drutu stalowego przymocowanego do poprzeczki. Powinno wyglądac to jak niżej.
Pokaz!
Jeśli mamy przygotowane wszystko co trzeba to możemy przystąpić do doświadczenia.
Na dno niewielkiej zlewki wlewamy 1-2cm3 acetonu, a następnie dobieramy tak długość zdrutu, na którym jest zawieszona miedziana blaszka, by znajdowała się ona tuż nad roztworem. Jest to bardzo ważne! Blaszka nie może być zanurzona w acetonie, ani być zawieszona w zbyt dużej odległości od jego powierzchni. Teraz możemy przystąpić do inicjacji reakcji: blaszkę musimy nieco podgrzać w płomieniu palnika lub zapalniczki, a następnie szybko (tak by nie zdążyła ostygnąć) zawiesić ją nad powierzchnią cieczy. Uzyskany efekt można zobaczyć poniżej:

Miedź zamiast ostygnąć zaczyna się rozgrzewać aż do momentu, kiedy zaczyna świecić pomarańczowym światłem! Wymaga to z pewnością dosyć wysokiej temperatury.
Świecenie rozżarzonej blaszki widać wyraźnie nawet w jasno oświetlonym pomieszczeniu.
Wyjaśnienie
Aceton jest związkiem z grupy ketonów. Jest bardzo lotny i łatwopalny, pali się jasnym płomieniem. W przedstawionym doświadczeniu warunki jednak nie dopuszczają do jego zapłonu.
Podobnie jak w procesie spalania dochodzi tutaj do gwałtownego łączenia z tlenem, dzieje się to jednak na drodze katalitycznej. Miedź jest tutaj katalizatorem kontaktowym; na powierzchni wstępnie podgrzanej miedzi pary acetonu, którymi z racji jego lotności jest wypełniona zlewka, zostają utlenione tlenem atmosferycznym. Produktami tej reakcji jest głównie dwutlenek węgla i para wodna, powstają także niewielkie ilości innych związków. W czasie tego procesu zostają uwolnione duże ilości energii na sposób ciepła, dzięki czemu blaszka rozgrzewa się coraz bardziej.
Można dostrzec także inne ciekawe zjawisko: rozgrzana blaszka nie świeci równomiernie. Po powierzchni miedzi przemykają naprzemienne fale ciemniejszej i jaśniejszej barwy. Jest to spowodowane nierównomiernym rozkładem temperatur, czego powodem jest niejednakowe rozmieszczenie w całej objętości zlewki obu substratów: par acetonu i tlenu. Na drodze konwekcji dochodzi też do ciągłego mieszania tych dwóch substancji gazowych, przez co do powierzchni blaszki dociera raz mniej, raz więcej reagentów, co skutkuje różnicami w wydajności reakcji i uzyskiwanej temperaturze.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Döbereiner J. W., Glühendes Verbrennen des Alkohols durch verschiedene erhitzte Metalle und Metalloxyde, Journal für Chemie und Physik, 34, 1822, str. 91-92,
- Masel R. I., Principles of Adsorption and Reaction on Solid Surfaces, Wiley Series in Chemical Engineering, Wiley-Interscience, New York, 1996,
- Ma Z., Zaera F., Heterogeneous Catalysis by Metals, w: Encyclopedia of Inorganic Chemistry, John Willey, 2006,
- Swathi R.S., Sebastian K.L., Molecular mechanism of heterogeneous catalysis, Resonance, Vol. 13, Issue 6, 2008, str. 548-560,
- Zhang J., Liu X., Blume R., Zhang A., Schlögl R., Su D. S., Surface-Modified Carbon Nanotubes Catalyze Oxidative Dehydrogenation of n-Butane, Science, 322 (5898), 2008, str. 73–77.
Marek Ples


