Dwubarwna elektroliza
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (5/2022):

Elektrolizą nazywamy zbiór wszelkich zmian struktury chemicznej substancji, zachodzących pod wpływem przyłożonego do niej zewnętrznego napięcia elektrycznego. Często pojęcie to zawęża się do procesów rozkładu zachodzących pod wpływem przepływu prądu elektrycznego przez ulegający dysocjacji elektrolit. Elektrolizie towarzyszyć może szereg dodatkowych zjawisk. Należy tu wspomnieć transport jonów do elektrod, wtórne przemiany jonów na elektrodach i inne. W sensie technologicznym przez elektrolizę rozumie się wszystkie te procesy łącznie [1].
Elektroliza zachodzi więc w układach, w których występują substancje zdolne do rozpadu (dysocjacji) na jony, czyli do jonizacji.
W elektrolizie elektroda naładowana ujemnie (na której zachodzi redukcja) jest nazywana katodą, a elektroda naładowana dodatnio, na której zachodzi utlenianie - anodą. Każda z elektrod przyciąga do siebie przeciwnie naładowane jony. Do katody dążą więc dodatnio naładowane kationy, a do anody ujemnie naładowane aniony. Po dotarciu do elektrod jony przekazują im swój ładunek, a czasami wchodzą też z nimi w reakcję chemiczną, na skutek czego zamieniają się w obojętne elektrycznie związki chemiczne lub pierwiastki [2] [3].
Elektrolizę wykorzystuje się powszechnie na różne sposoby, między innymi do produkcji metali takich jak glin Al, wytwarzania gazów (np. wodór H2, tlen O2 i chlor Cl2), oraz do galwanizacji, czyli elektrolitycznego pokrywania przedmiotów metaliczną powłoką.
Zjawiska z dziedziny elektrochemii są często postrzegane przez uczniów jako skomplikowane i trudne do przyswojenia. Okazuje się jednak, że elektrolizę możemy zaprezentować na wiele sposobów. Wybrałem jedną z ciekawszych wizualnie reakcji elektrolitycznych.
Doświadczenie
Potrzebujemy jedynie kilka łatwych do zdobycia substancji:
- skrobia,
- alkoholowy roztwór fenoloftaleiny C20H14O4,
- jodek potasu,
- drobny sprzęt laboratoryjny
Skrobia, czy też mąka ziemniaczana to produkt uzyskiwany z bulw pędowych ziemniaków Solanum tuberosum. Zawiera około 84% skrobi. Najważniejszym z pozostałych składników jest woda, której ilość jest zależna od wilgotności względnej powietrza, w którym jest przechowywana mąka [4]. Skrobia ziemniaczana ma postać sypkiego, matowego proszku o barwie czysto białej, bez obcych zapachów i posmaków (Fot.1). Substancja ta ściskana w dłoni charakterystycznie chrzęści.
Z kolei fenoloftaleina jest organicznym związkiem chemicznym, stosowanym głównie jako wskaźnik pH. W warunkach normalnych jest to biała substancja krystaliczna. Jej rozpuszczalność w wodzie jest niewielka, lepsza natomiast w alkoholach. Fenoloftaleina jest wskaźnikiem alkacymetrycznym, tzn. zmienia formę z bezbarwnej w środowisku słabo kwasowym lub obojętnym na malinowoczerwoną w środowisku umiarkowanie zasadowym. Zalecana jest głównie do miareczkowania roztworów słabych kwasów mocnymi zasadami, gorsze wyniki uzyskiwane są dla miareczkowania silnie rozcieńczonych mocnych kwasów mocnymi zasadami. Zakres pH zmiany bezbarwna-malinowoczerwona wynosi 8,3–10,0. W skrajnych wartościach pH zachodzą dodatkowe zmiany: w roztworach silnie kwasowych przybiera kolor pomarańczowy lub żółty na skutek przejścia w karbokation trytylowy, natomiast w środowisku silnie zasadowym staje się bezbarwna. W lecznictwie fenoloftaleina była stosowana niekiedy jako środek przeczyszczający, ale musimy pamiętać, aby niepotrzebnie nie wystawiać naszego organizmu na większe dawki tej substancji, ponieważ może mieć ona działanie szkodliwe.
Kolejną potrzebną nam substancją jest jodek potasu, a więc sól potasowa kwasu jodowodorowego HI. Tworzy bezbarwne kryształy łatwo rozpuszczalne w wodzie (Fot.2). W wyniku elektrolizy stopionego jodku potasu powstaje jod I i potas K.
Pamiętajmy, że chociaż w tym doświadczeniu nie wykorzystujemy żadnych silnie toksycznych substancji, to musimy uważać jak zawsze przy pracy z chemikaliami.
Pierwszą rzeczą, jaką musimy zrobić jest przygotowanie roztworu skrobi. Substancja ta nie rozpuszcza się w zimnej wodzie. Dlatego najłatwiej jest to osiągnąć dodając do kilkunastu cm3 zimnej wody około 0,5 g mąki ziemniaczanej, a następnie dopełniając do objętości 250 cm3 wodą bliską wrzenia i mieszając. Po ochłodzeniu roztwór warto jeszcze rozcieńczyć 2-5x wodą o temperaturze pokojowej. Zarówno ten roztwór, jak i pozostałe substancje potrzebne do doświadczenia można zobaczyć na Fot.3.
Aby otrzymać elektrolit, do otrzymanego roztworu skrobi dodajemy niewielką ilość jodku potasu – szczyptę, której wielkość należy dobrać eksperymentalnie - i mieszamy do rozpuszczenia. Następnie dodajemy parę kropli 1% etanolowego roztworu fenoloftaleiny. Najlepiej byłoby, gdyby roztwór był przygotowany na wodzie destylowanej, ale jeśli użyjemy wody z kranu, to efekt reakcji też będzie widoczny. Roztwór wtedy może być tylko nieco bardziej mętny.
Następnie musimy zestawić prosty elektrolizer. Reakcję można przeprowadzać w pojedynczym naczyniu, ale wtedy istnieje ryzyko wymieszania barw. Dlatego zastosujemy elektrolizer o dzielonej objętości, zbudowany ze zwykłych probówek. Jego schemat można zobaczyć na Rys.1.
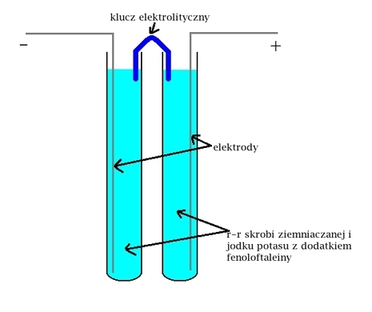
Klucz elektrolityczny jest fragmentem zwiniętej gazy, ręcznika papierowego lub chusteczki higienicznej. Należy nasączyć go roztworem i wtedy taki klucz umożliwi przepływ prądu elektrycznego między naczyniami. Elektrody najlepiej byłoby wykonać z materiału bardziej obojętnego chemicznie, takiego jak grafit lub platyna, ale w toku doświadczeń okazało się, że w opisanych warunkach dobrze sprawują się nawet te wykonane z nieizolowanego drutu miedzianego. Dla zwiększenia powierzchni reakcji można je zwinąć w spiralę. Gotowy do elektrolizy układ przedstawia Fot.4.
Czas na elektrolizę!
Do elektrod podłączamy źródło prądu stałego o niskim napięciu, np. 4,5V (w szereg z elektrolizerem warto włączyć opornik elektryczny o wartości kilku omów lub choćby miniaturową żarówkę). Prawie natychmiast roztwory w probówkach zaczynają się zabarwiać: wokół katody na różowo, zaś wokół anody na niebiesko-granatowo. Po paru minutach barwy stają się wyraźnie widoczne (Fot.5).
W razie, gdyby roztwór barwił się jedynie w bezpośrednim pobliżu elektrod, warto zamieszać ciecz przez wstrząśnięcie.
Wyjaśnienie
W roztworze cząsteczki jodku potasu dysocjują na odpowiednie jony według poniższego równania:
W efekcie w roztworze obecne są jednododatnie kationy potasowe K+ i jednoujemne (w uproszczeniu, ponieważ mogą powstawać też jony wielojodkowe) aniony jodkowe I-.
Po przyłożeniu do elektrod napięcia jony na zasadzie oddziaływania elektrostatycznego będą podążać (migrować) do odpowiednich elektrod: kationy do elektrody ujemnej, a aniony do dodatniej.
Jako że standardowy potencjał redukcji potasu jest niższy niż wodoru (-2,9V w odniesieniu do elektrody wodorowej), to na katodzie będzie dochodziło do rozkładu wody, a uwolniony wodór H2 uleci z układu, w roztworze natomiast powstanie nadmiar reszt wodorotlenkowych OH-, których ładunek, dla zachowania elektroobojętności całego układu, kompensowany jest ubytkiem utlenianych do cząsteczek jodu I2 jonów I- na anodzie, do której dążą w polu elektrycznym między ealektrodami. Spowoduje to oczywiście wzrost pH w przestrzeni katodowej, dzięki czemu fenoloftaleina zabarwi się tam na malinowy kolor, a pierwiastkowy jod zwiąże się (przy udziale jonów jodkowych) z obecną w roztworze skrobią dając niebieskie zabarwienie.
Literatura:
- [1] Carmo M., Fritz D., Mergel J., Stolten D., A comprehensive review on PEM water electrolysis, International Journal of Hydrogen Energy, 2013, vol. 38, Iss. 12, str. 4901-4934 powrót
- [2] Laidler K. J., The world of physical chemistry, Oxford University Press, 1995, str. 219-220 powrót
- [3] Tilley R. J. D., Understanding solids: the science of materials, John Wiley and Sons, 2004, str. 281 powrót
- [4] Masewicz Ł. et al., Water activity anf hydrated starch aerogles, Proceedings of the 14th International Conference on Polysaccharides-Glycosicence, Prague, 2018, s. 87-89 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples




