Dendryty miedzi. Prawie jak żywe
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (1/2019):

Nauki przyrodnicze, jak zresztą ich nazwa wskazuje, istnieją w nierozerwalnym związku z otaczającym nas światem. Niestety często się o tym zapomina, także w nauczaniu. Poza innymi przyczynami – czasem jedynie lenistwem niektórych dydaktyków – istnieje tutaj pewna przyczyna obiektywna. Otóż specjalizacja i zaawansowanie w ramach nauk przyrodniczych zwiększyły się do tego stopnia, że wiele zjawisk jest całkowicie niezrozumiałych dla odbiorcy niezaznajomionego z tematem. Dlatego problemy, z którymi spotykają się naukowcy mogą się wydawać ogółowi społeczeństwa całkowicie oderwane od rzeczywistości. Jedną z ról nauczyciela czy wykładowcy powinno być więc ukazanie w przystępny sposób świata i rządzących nim praw (opisywanych przez naukę) jako całości, ponieważ nawet zdawałoby się odległe od siebie zjawiska ujawniają często bardzo interesujące związki. Jednym z fenomenów, których przybliżenie może być przydatne w tym celu jest tzw. samoorganizacja.

Samoorganizację można określić jako duży zbiór zjawisk, w których elementy układu złożonego ulegają spontanicznemu uporządkowaniu. Obserwuje się wtedy powstawanie zorganizowanych struktur przestrzennych lub korelacji czasowych na skutek oddziaływań zachodzących pomiędzy elementami układu, a także między układem i jego otoczeniem. Jednym z przejawów samoorganizacji jest istnienie tzw. chemicznych reakcji oscylacyjnych [1]. Możemy tu wymienić choćby reakcję Biełousowa-Żabotyńskiego, Briggsa-Rauchsera, czy bardziej klasycznie powstawanie tzw. pierścieni Lieseganga [2].
O samoorganizacji w aspekcie wzrostu pięknych dendrytycznych kryształów srebra Ag (Fot.1) pisałem w jednym z dawniejszych numerów Chemii w Szkole [3]. Omówiłem tam dokładny mechanizm tego zjawiska, który jest (poza wykorzystanym metalem) właściwie identyczny w tym przypadku. Dlatego po dokładniejsze informacje w tym zakresie odsyłam do wspomnianego tekstu – tutaj zostanie umówiony jedynie proces elektrochemiczny odpowiedzialny za wydzielenie metalu z roztworu.
Rozumiem, że koszt związków srebra bywa dosyć duży, a poza tym niektóre z nich (jak właśnie wykorzystany we wspomnianym doświadczeniu azotan(V) srebra AgNO3) mogą być postrzegane jako kłopotliwe z racji np. barwienia skóry nieostrożnego eksperymentatora na czarno. Plamy takie powstają z rozdrobnionego metalicznego srebra i trudno je usunąć.
Chcąc wyjść naprzeciw Szanownemu Czytelnikowi chciałbym w niniejszym artykule – który powinien być traktowany jako swego rodzaju dodatek – przedstawić podobne doświadczenie. Tym razem wyhodujemy jednak kryształy miedzi Cu, wykorzystując tanie i łatwo dostępne substancje.
Doświadczenie
W celu hodowli kryształów metalicznej miedzi potrzebujemy odpowiedniego źródła jonów miedzi(II) Cu2+. Dobrym rozwiązaniem jest użycie siarczanu(VI) miedzi(II) CuSO4, występującego najczęściej jako pentahydrat formujący piękne, niebieskie kryształy (Fot.2). Sól nie jest silnie toksyczna, ale trzeba unikać bezpośredniego jej kontaktu z naszym ciałem.
Musimy sporządzić roztwór soli miedzi w wodzie. W przypadku wspomnianego siarczanu wystarczy w kilkudziesięciu centymetrach sześciennych wody destylowanej rozpuścić kilka niewielkich kryształków. Stężenie roztworu nie powinno być zbyt duże – musi on pozostać bezbarwny lub ewentualnie wykazywać ledwie uchwytne niebieskie zabarwienie.
Teraz musimy przygotować prosty przyrząd, którego schemat przedstawia Rys.1. Na mikroskopowym szkiełku podstawowym a zostały umieszczone równolegle dwa cienkie przewodniki miedziane b, których średnica wynosi około 0,4mm. Są one umocowane do szkiełka za pomocą pasków taśmy elektroizolacyjnej c (można wykorzystać też biurową taśmę klejącą). Na przewodnikach jest umieszczone szkiełko nakrywkowe d.
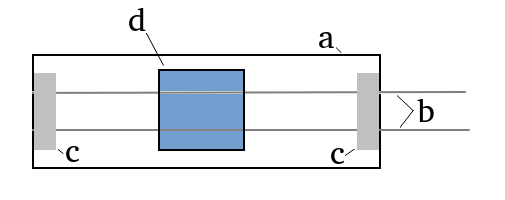
Pod szkiełko wprowadzamy kilka kropli roztworu soli miedzi, tak by przewodniki miedziane były w nim zanurzone. Pomagają w tym zjawiska kapilarne. Ważne jest, aby pod szkiełkiem nie zamknąć pęcherzyków powietrza.
Następnie do przewodników podłączamy źródło stałego prądu elektrycznego o napięciu kilkunastu woltów - nie większym, ponieważ nie chcemy ryzykować możliwości porażenia. Wzrost struktur najlepiej śledzić przez szkło powiększające. Z racji specyficznej budowy układu doświadczalnego całe szkiełko można umieścić też w zaciskach stolika mikroskopu i za jego pomocą prowadzić obserwacje. Kryształy rozpoczynają swój wzrost od przewodnika połączonego z ujemnym biegunem źródła zasilania i kierują się do przeciwnej elektrody. Prąd należy wyłączyć zanim kryształy dotrą do elektrody dodatniej, ponieważ może to spowodować zwarcie. Przy wspomnianym napięciu wzrost struktur jest bardzo szybki i doskonale widoczny gołym okiem. Już po kilkunastu – kilkudziesięciu sekundach możemy podziwiać piękne struktury zbudowane z metalicznej miedzi o czym świadczy dobitnie ich czerwonawy kolor (Fot.3). Uzyskane struktury do złudzenia przypominają rośliny: paprocie, trawy czy nawet drzewa. Ich pseudoorganiczna forma sprawia niesamowite wrażenie, szczególnie jeśli uwzględnimy w jak prosty sposób je uzyskaliśmy.
Modyfikacja warunków doświadczenia pozwala na uzyskanie odmiennych rezultatów. Jeśli zastosujemy niższe napięcie, to wzrost struktur będzie zdecydowanie wolniejszy, ale będą one też bardziej rozgałęzione. Fotografia 4 przedstawia efekt uzyskany przy napięciu 4V, zastosowano też cieńsze przewodniki.
Powstałe w ten sposób kryształy metalu można traktować z pewnym przybliżeniem jako struktury fraktalne – wykazują one np. samopodobieństwo. Objawia się to tym, że obierając niewielki fragment obiektu i powiększając go uzyskujemy obraz podobny do całości [4]. Łatwo to zauważyć porównując widok spod mikroskopu (Fot.5) z poprzednim zdjęciem. Zwraca uwagę też wielka subtelność, a według mnie także swoiste piękno wyhodowanych dendrytów.
Przy obserwacjach trzeba pamiętać, że każdy mniej delikatny ruch czy wstrząs może uszkodzić hodowane struktury. Po doświadczeniu układ elektrolityczny należy umyć w wodzie destylowanej, pozostałości wytrąconej miedzi usunąć papierowym ręcznikiem i całość wysuszyć.
Wyjaśnienie
Podczas przepływu prądu elektrycznego przez roztwór na katodzie (elektrodzie ujemnej) dochodzi do redukcji obecnych w roztworze kationów miedzi(II) Cu2+ dzięki ciągłemu dopływowi elektronów:
Na elektrodzie dodatniej czyli anodzie materiał elektrodowy jest utleniany:
W koncentracja jonów miedziowych w roztworze pozostaje na stałym poziomie – miedź z anody ulega roztworzeniu w roztworze, natomiast na katodzie zostaje wydzielona z roztworu.
Wydzielona metaliczna miedź formuje obserwowane struktury. Za ich fantazyjny kształt odpowiada między innymi zjawisko agregacji ograniczonej dyfuzją.
Literatura:
- [1] Orlik M., Reakcje oscylacyjne - porządek i chaos, Wydawnictwa Naukowo-Techniczne, Warszawa, 1996 powrót
- [2] Ples M., Porządek z chaosu. O samoorganizacji i pierścieniach Lieseganga, Chemia w Szkole, 1 (2016), Agencja AS Józef Szewczyk, str. 15-19 powrót
- [3] Ples M., Metaliczne rośliny. Krystaliczne dendryty srebra, Chemia w Szkole, 3 (2015), Agencja AS Józef Szewczyk, str. 6-10 powrót
- [4] Kudrewicz J., Fraktale i chaos, Wydawnictwa Naukowo-Techniczne, Warszawa, 1996 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Poniżej przedstawiam film przedstawiający wzrost dendrytów.
Marek Ples




