W szczawiowym blasku
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (1/2022):

Na wstępie chciałbym wspomnieć pewną ważną dla mnie książkę. Przeczytałem ją po raz pierwszy w dzieciństwie, ale powracałem do niej później wielokrotnie i za każdym razem była doskonałym źródłem nie tylko rozrywki, ale też wielu przemyśleń, a nawet inspiracji. Mam tu na myśli napisane przez Jonathana Swifta w 1726 roku "Podróże do wielu odległych narodów świata, w 4 częściach, opisane przez Lemuela Guliwera, najpierw lekarza okrętowego, później kapitana kilku statków", nazywane częściej z uwagi na długość oryginalnego tytułu po prostu Podróżami Guliwera. Powieść ta jest, przynajmniej moim zdaniem, jedną z najbardziej celnych satyr na ludzką naturę, a jednocześnie stanowi wysmakowaną parodię popularnych - zarówno w czasach współczesnych autorowi, jak i dziś - powieści "podróżniczych", a w istocie po prostu fantastycznych.
W rozdziale piątym trzeciej części "Podróży…" bohater powieści po opuszczeniu latającej wyspy Laputy dostaje się do kraju Balnibarbów, gdzie między innymi zwiedza szacowną Akademię tego państwa, opisując m.in. badania jednego z tamtejszych uczonych:
Pracował on przez lat osiem nad jednym ciekawym projektem wyciągnienia z ogórków promieni słonecznych, żeby je, zamknąwszy w butlach i mocno zatkawszy, użyć na ogrzewanie powietrza latem w dniach chłodnych i niepogodnych. […] Ale żalił się, że ma dochody małe. […] Dałem mu mały podarunek, gospodarz mój bowiem opatrzył mnie pieniędzmi, wiedząc, że ci uczeni mają zwyczaj wypraszać sobie cokolwiek u zwiedzających Akademię.
Jest to oczywisty paszkwil Swifta na realnie istniejące brytyjskie Towarzystwo Królewskie, którego członkowie mieli jakoby trwonić środki na nie zawsze sensowne badania. Oczywiście, opisany proces odzyskiwania promieni słonecznych z ogórków jest całkowitą fantazją, ale wizja pisarza daje nam pole do pewnych rozmyślań, które mogą dać początek rzeczywistym doświadczeniom.
Muszę zaznaczyć, że dzisiejszy artykuł jest może nieco nietypowy, ponieważ nieco bardziej niż zwykle nawiązuje do chemii, ale musimy pamiętać, że biologia sama w sobie łączy w sobie tematykę wielu dziedzin – w tym i wspomnianej przed chwilą.
Szczaw
Chcę zaproponować, aby z pewnych powodów - które niedługo staną się jasne - w naszych rozważaniach wyjść jednak nie od ogórka siewnego Cucumis sativus z rodziny dyniowatych Cucurbitaceae, a od innej rośliny. Będzie nią gatunek z rodzaju szczaw Rumex, a dokładniej szczaw zwyczajny Rumex acetosa (rodzina rdestowate Polygonaceae). Roślina ta występuje w całej Europie, na dużych połaciach Azji, w Afryce Północnej, a nawet w Australii [1]. Wraz z europejskimi osadnikami szczaw rozprzestrzenił się także w Ameryce południowej. W Polsce, o czym doskonale wiemy, gatunek ten jest pospolity na prawie całej powierzchni kraju, poza regionami górskimi.
Szczaw jest zielną rośliną wieloletnią, a więc byliną (Fot.1). Okres kwitnienia przypada od maja do czerwca, a nasiona są przystosowane do rozsiewane przez wiatr, co nazywamy anemochorią. Jeśli chodzi o miejsce życia, to szczaw jest rośliną stosunkowo wymagającą - rośnie na glebach żyznych, w szczególności bogatych w związki azotowe. W Polsce jest pospolity na polanach, łąkach oraz przydrożach, także jako roślina ruderalna i często traktowany jak chwast.
Szczaw zwyczajny (a także inne gatunki z tego rodzaju) jest od wieków wykorzystywany jako roślina lecznicza, np. przy dolegliwościach wątroby i nerek. Liście szczawiu są jadalne i znajdują zastosowanie w sztuce kulinarnej do przyrządzania zup, sosów i sałatek.
Tutaj możemy się zastanowić jakiemu właściwie składnikowi zupa szczawiowa zawdzięcza swój charakterystyczny, lekko kwaskowaty smak? Tak! Naukowcem-przyrodnikiem nie przestaje się być nawet przy obiedzie!
Tkanki szczawiu – między innymi liście i ich ogonki – zawierają stosunkowo duże ilości kwasu szczawiowego C2H2O4 i jego związków. Warto zaznaczyć, że podobną cechę wykazują także inne rośliny z rodzaju rdestowatych, między innymi rzewień, czyli rabarbar Rheum [2].
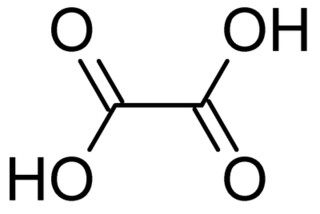
Omawiana substancja jest zwyczajowo nazywana kwasem szczawiowym, a jej nazwa systematyczna to kwas etanodiowy. Jest to organiczny związek chemiczny i najprostszy kwas dikarboksylowy, to jest posiadający w swojej strukturze dwie grupy karboksylowe -COOH, o czym przekonuje nas wzór strukturalny tej substancji (Rys.1).
Kwas ten w warunkach normalnych występuje zwykle w postaci dihydratu i jest białym, krystalicznym ciałem stałym (Fot.2). Rozpuszcza się dosyć dobrze w wodzie, ale też w wielu rozpuszczalnikach organicznych, takich jak etanol C2H5OH i eter dietylowy C4H10O. Substancję tę potrafimy otrzymywać na drodze syntetycznej, ale nic nie stoi na przeszkodzie (poza oczywiście kosztami), aby izolować ją z surowców naturalnych.
Warto pamiętać, że przy dużej ekspozycji kwas szczawiowy działa drażniąco na skórę i błony śluzowe. Jeśli chodzi o drogę pokarmową, to nawet w ilościach spotykanych w żywności może być szkodliwy, ponieważ łatwo reaguje z jonami wapnia, tworząc prawie nierozpuszczalny w wodzie szczawian wapnia CaC2O4 formujący kamienie nerkowe. Z tego samego powodu spożywanie dużych ilości pokarmów zawierających kwas szczawiowy i jego związki może prowadzić także do zubożenia organizmu w wapń.
Doświadczenie
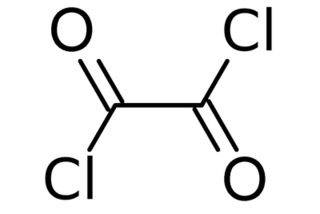
Kwas szczawiowy posiada bardzo wiele zastosowań w przemyśle i analizie chemicznej. Nas dziś jednak interesują interesujące właściwości pewnej pochodnej tego kwasu, a konkretnie dichlorku oksalilu C2O2Cl2. Związek ten należy do grupy tak zwanych chlorków acylowych, to znaczy takich pochodnych kwasów karboksylowych, w których grupa hydroksylowa -OH została zastąpiona atomem chloru. Skoro kwas szczawiowy posiada dwie takie grupy, to logiczne jest, że w pochodzącym od niego chlorku acylowym do ich podstawienia zostaną wykorzystane dwa atomy chloru (Rys.2).
Czysty dichlorek oksalilu jest bezbarwną, lotną cieczą (Fot.3).
Przy wszelkich manipulacjach z tą substancją należy wykazywać daleko idącą ostrożność, ponieważ działa ona bardzo szkodliwie na organizm: w kontakcie z naszymi tkankami niszczy je, powoduje ciężkie oparzenia (także wewnątrz organizmu, podczas wdychania par dichlorku). Samodzielnie wykazuje działanie toksyczne, a w kontakcie z wodą dodatkowo uwalnia inne, też toksyczne produkty. Substancja ma nieprzyjemny i drażniący zapach. Prace z dichlorkiem oksalilu należy prowadzić z zastosowaniem odpowiednich środków ochrony osobistej.
Dichlorek oksalilu jest często używany w syntezie chemicznej np. w celu wytworzenia innych chlorków kwasowych z odpowiednich kwasów karboksylowych. Wykazuje on jednak jeszcze jedną, bardzo widowiskową, a także ciekawą z naszego punktu widzenia cechę. Aby ją zaobserwować trzeba jednak poczynić pewnie przygotowania.
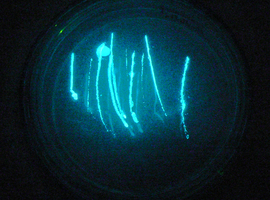
W celu wykonania doświadczenia – które w całości musi odbywać się pod sprawnie działającym wyciągiem – na dno wysokiej, niewielkiej zlewki należy nanieść dosłownie jedną lub dwie krople dichlorku oksalilu, a następnie przykryć naczynie szkiełkiem zegarkowym, szalką Petriego lub w inny sposób. Osobno trzeba przygotować mieszaninę rozpuszczalnika organicznego (np. mało toksycznego octanu etylu C4H8O2 - głównego składnika zmywaczy do paznokci), nadtlenku wodoru 3% H2O2 (aptecznej wody utlenionej, dużo lepiej jednak nadaje się roztwór 30%) i odpowiedniego barwnika fluorescencyjnego (w opisanym przypadku wykorzystano 9,10-difenyloantracen - barwnik fluoryzujący niebiesko w świetle UV, ale można go zastąpić także innymi). Jeśli teraz nasączymy roztworem bawełniany koniec patyczka kosmetycznego i umieścimy go w parach dichlorku oksalilu, to rozbłyśnie on pięknym, niebieskim światłem (Fot.4). Najlepszy efekt doświadczenia uzyskamy przeprowadzając je w przyćmionym świetle lub nawet w ciemności.
Świecenie utrzymuje się tak długo, jak tylko wystarczy reagentów. Potem patyczek można nasączyć nową porcją roztworu barwnika i nadtlenku wodoru, a w razie wyczerpania par dichlorku umieścić w zlewce kolejną jego kroplę. Po doświadczeniach pozostałości należy umieścić w odpowiednich pojemnikach i przekazać do zakładu utylizującego tego rodzaju odpady.
Wyjaśnienie
Mamy tu do czynienia z fascynującym zjawiskiem chemiluminescencji, w czasie której dochodzi do emisji promieniowania elektromagnetycznego z zakresu światła widzialnego na drodze innej niż termiczna. Chemiluminescencja nie wiąże się bezpośrednio z jakimkolwiek ogrzewaniem świecących substancji i dlatego bywa też nazywana zimnym światłem.
Reakcje, w przypadku których możemy obserwować świecenie zachodzą zwykle według charakterystycznego schematu, który można opisać równaniem:
Jak widzimy, w reakcji substratu X powstaje produkt przejściowy [Y]* istniejący w stanie wzbudzonym. Stan taki charakteryzuje się wysoką energią, jest więc termodynamicznie nietrwały. Produkt przejściowy ulega następnie spontanicznej reakcji, w wyniku której przekształca się w produkt ostateczny Y (o niższej energii). Zasada zachowania energii mówi jednak, że nie może ona powstać z niczego ani zniknąć bezpowrotnie - różnica między produktem przejściowym a ostatecznym przekształca się w energię promieniowania elektromagnetycznego hν [3].
W opisanej reakcji podczas utleniania par dichlorku oksalilu za pomocą nadtlenku wodoru powstają przejściowo produkty występujące w stanie wzbudzonym. W tym przypadku nie oddają one jednak bezpośrednio energii wzbudzenia w postaci światła widzialnego – energia ta zostaje przeniesiona na cząsteczki barwnika fluorescencyjnego, które wracając do stanu podstawowego wypromieniowują ją do środowiska jako światło o charakterystycznej dla siebie barwie. Zjawisko takie nazywamy chemiluminescencją sensybilizowaną, ponieważ barwnik pełni tu rolę sensybilizatora, czyli swoistej substancji uczulającej.
Jak więc widzimy, może nie dosłownie, ale możliwe jest uzyskanie światła ze szczawiu, a przynajmniej przy wykorzystaniu pochodnych substancji w nim występujących. Wykorzystanie w tym celu ogórka byłoby dużo trudniejsze, a może nawet niemożliwe, ponieważ występują w nim jedynie śladowe ilości kwasu szczawiowego.
Opisane zjawisko chemiluminescencji, czyli powstawania promieniowania elektromagnetycznego z zakresu światła widzialnego kosztem energii wyzwolonej w czasie zachodzenia specyficznych reakcji chemicznych występuje także w naturze i jest wtedy nazywane bioluminescencją. Wykazuje ją wiele organizmów: niektóre owady (świetlik świętojański Lampyris noctiluca, iskrzyk Phausis splendidula [4] i inne), protisty (m.in. bruzdnice Dinoflagellata z rodzaju Pyrocystis), bakterie (np. Aliivirio fischeri, na Fot.5), czy nawet grzyby (z krajowych gatunków np. opieńka miodowa Armillaria mellea i łycznik ochrowy Panellus stipticus) i inne.
Literatura:
- [1] Baza danych Germplasm Resources Information Network, wyszukiwarka dostępna pod adresem: https://npgsweb.ars-grin.gov [dostęp: 28.11.2021] powrót
- [2] Hassa R., Mrzigod J., Podręczny słownik chemiczny (wyd. I), Videograf II, Katowice, 2004, str. 216 powrót
- [3] Ples M., Światło z retorty, Chemia w Szkole, 5 (2014), Agencja AS Józef Szewczyk, str. 33-34 powrót
- [4] Ples M., Iskrzyk - żywa latarnia, Biologia w Szkole, 4 (2021), Forum Media Polska Sp. z o.o., str. 52-56 powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples