Całkiem niezwykła herbatka
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (4/2015):

Chemiluminescencja z udziałem polifenoli zawartych w zielonej herbacie
Herbatą nazywamy zwykle napój, którego głównym składnikiem jest napar przyrządzany z liści i pąków grupy roślin należących do rodzaju Camellia, w szczególności herbaty chińskiej Camelia sinensis. Rośliny te uprawiane są w licznych krajach strefy zwrotnikowej.
Początki herbaty giną w pomroce dziejów. Najczęściej przytaczaną legendą jest ta mówiąca o mitycznym chińskim cesarzu Shennongu, który już w 2737 roku p.n.e. miał przypadkowo uzyskać pierwszy napar z liści herbaty. Jednak dopiero X wiek p.n.e. przynosi pierwsze wiarygodne zapiski na ten temat.
Do Europy herbata trafiła w początkowych latach XVII wieku, kiedy przywieźli ją tu ze swoich wypraw Holendrzy. Z biegiem czasu napój ten stał się jednym z najpopularniejszych, chociaż początkowo ze względu na wysoką cenę smakiem herbaty mogli się cieszyć jedynie najbardziej zamożni.
Myślę, że nie będzie przesadą jeśli stwierdzę, że herbata i wszystko co z nią związane bardzo silnie wrosła w naszą kulturę. Temat ten wykorzystał choćby Lewis Carrol w swojej najsłynniejszej książce:
– Nalej sobie więcej herbaty – rzekł z wielką powagą Szarak.
– Jeszcze w ogóle nie piłam – odparła Alicja urażona tą propozycją. – Trudno więc, abym nalała sobie więcej.
– Chciałaś powiedzieć, że trudno, abyś nalała sobie mniej – wtrącił się Kapelusznik. – Przecież znacznie łatwiej jest nalać sobie więcej niż nic.
Problem odmierzania ilości cieczy mniejszej niż nic jest niewątpliwie interesujący, ale pozostawmy go Alicji i Kapelusznikowi. My natomiast zastanówmy się nad inną kwestią, która tylko pozornie wydaje się absurdalna: czy herbata może świecić? Okazuje się, że tak – i nie trzeba do tego żadnej magii, a jedynie nieco wiedzy i chęci do eksperymentowania [1].
Wykonanie
By przeprowadzić opisywane doświadczenie musimy zaopatrzyć się w potrzebne substancje. Jak szanowny Czytelnik zapewne się domyśla, pierwszą z nich będzie herbata. Ważne jest by była to herbata zielona. W doświadczeniu wykorzystano herbatę sencha (Fot.1). Gatunek herbaty nie jest krytyczny – można wykorzystać inną herbatę zieloną, nawet ekspresową.
Poza herbatą będziemy potrzebowali także:
- paraformaldehyd OH(CH2O)nH,
- węglan sodu Na2CO3,
- nadtlenek wodoru H2O2 3%.
Paraformaldehyd jest polimerem z grupy polieterów. Związek ten jest homopolimerem, to znaczy składa się z powtarzających się podstawowych jednostek jednego rodzaju, czyli tzw. merów. Paraformaldehyd posłuży nam w doświadczeniu jako donor aldehydu mrówkowego HCHO. Do doświadczenia nadaje się związek, którego cząsteczki mają długość n=8-100 merów (Rys.1). Substancja ma zwykle postać białego proszku.
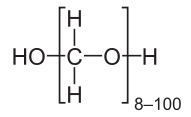
W razie braku węglanu sodu Na2CO3 związek ten można łatwo otrzymać w wyniku termicznego rozkładu wodorowęglanu sodu NaHCO3 (dostępnego w handlu spożywczym jako soda oczyszczona) według równania reakcji:
Reakcja ta zachodzi w temperaturze powyżej 60°C, wystarczy więc wyprażyć wyłożony cienką warstwą wodorowęglan, by otrzymać tak potrzebny nam węglan sodu.
Nadtlenek wodoru H2O2 w stężeniu 3% można kupić w aptece jako wodę utlenioną stosowaną przy dezynfekcji skaleczeń.
Należy pamiętać, że w czasie doświadczenia może dochodzić do uwalniania się pewnych ilości formaldehydu, który jest toksyczny. Węglan sodu działa drażniąco na oczy. Nadtlenek wodoru w stężeniu 3% jest nieszkodliwy, natomiast 30% jest silnie żrący – w kontakcie ze skórą powstają białe, odbarwione plamy, a przy dłuższej ekspozycji może dochodzić do zmian martwiczych. Należy zachować normalne przy pracy z chemikaliami środki ostrożności.
Pierwszą czynnością, którą musimy wykonać jest przygotowanie wywaru herbacianego. Odważamy więc 1,8-2g herbaty i przenosimy ją do 200cm3 wody o temperaturze około 90°C. W przypadku wykorzystania herbaty ekspresowej wystarczy jedna torebka. Płyn powinien być mieszany w ciągu następnych trzech minut. Po tym czasie klarowny płyn o barwie zielonkawo-żółtej powinien zostać odsączony.
W 40cm3 powstałego wyciągu herbacianego trzeba rozpuścić 1,6g paraformaldehydu i 4g węglanu sodu. Paraformaldehyd dosyć opornie rozpuszcza się w wodzie, ale dodatek węglanu sodu i mieszanie wyraźnie przyspiesza ten proces. Mimo wszystko całkowite rozpuszczenie obu substancji wymaga nieco czasu. W tym czasie roztwór ciemnieje i nabiera barwy brązowej (Fot.2).
Płyn należy ochłodzić do temperatury pokojowej. Odczyn roztworu powinien być zasadowy – najlepsze warunki dla zajścia opisywanej reakcji występują przy pH równym 11. Należy sprawdzić to za pomocą papierka wskaźnikowego lub w inny sposób i w razie konieczności skorygować nieco ilość dodanego węglanu.
W tym momencie pomieszczenie trzeba zaciemnić i po chwili potrzebnej na przyzwyczajenie oczu do ciemności dodać do roztworu 40cm3 3% nadtlenku wodoru. Można też wykorzystać H2O2 o stężeniu 30% czyli perhydrol. Wtedy wystarczy użyć jedynie 1-2cm3 utleniacza. Po chwili roztwór zaczyna świecić niezbyt silnym, ale wyraźnie widocznym blaskiem o barwie czerwonej (Fot.3).
Emisja światła trwa kilka, kilkanaście sekund. W tym samym czasie roztwór się pieni – powstają pewne ilości gazów. Po reakcji roztwór przyjmuje barwę żółtą (Fot.4).
Dla większego, powiedziałbym nawet teatralnego efektu roztwór można przygotować w naczyniu może mniej odpowiednim z punktu widzenia chemika, natomiast bardziej pasującym do przedmiotu doświadczenia, tj. w filiżance (Fot.5). Naczynie po skończonej pracy trzeba oczywiście bardzo dokładnie i przynajmniej kilkukrotnie umyć.
Doświadczenie zwykle wywiera duże wrażenie na widzach z racji zaskakującego efektu chemiluminescencji. Zmiany barwy roztworu także są czynnikiem rodzącym zainteresowanie zachodzącymi w układzie procesami.
Wyjaśnienie
O typie reakcji, która zachodzi w opisywanym doświadczeniu donieśli Trautz i Schorigin już w pierwszych latach XX wieku [2]. W odkryciu pomógł przypadek. Wielu fotografów zauważyło, że podczas wywoływania zdjęć wykorzystywane przy tym roztwory świeciły dosyć słabym, ale wyraźnie dostrzegalnym w ciemni światłem. Okazało się, że za to dosyć zaskakujące zjawisko był odpowiedzialny stosowany jako wywoływacz pirogalol, czyli 1,2,3-trihydroksybenzen C6H6O3 (Rys.2).
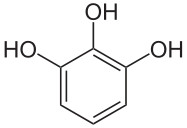
Pirogalol należy do polifenoli. Są to organiczne związki chemiczne z grupy fenoli, tj. związków zawierających grupy hydroksylowe związane bezpośrednio z atomami węgla w pierścieniu aromatycznym. Polifenole zawierają przynajmniej dwie grupy hydroksylowe.
Substancje te występują naturalnie w roślinach. Polifenole dzielą się na podatne na hydrolizę taniny będące estrami kwasu galusowego i sacharydów oraz związki należące do klasy fenylopropanoidów, takie jak flawonoidy i lignany. Największą i najlepiej poznaną grupą związków polifenolowych są flawonoidy [3].
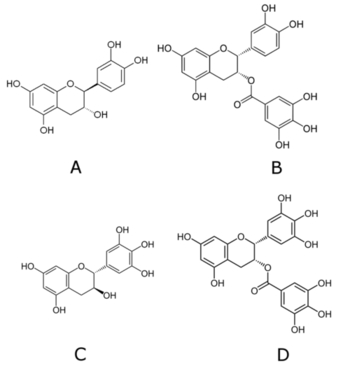
Wiele związków polifenolowych występuje także w zielonej herbacie. Na Rys.3 przedstawiono wzory tylko niektórych z nich [4].
Reakcji Trautza-Schorigina ulega nie tylko pirogalol, ale także wiele innych polifenoli, także tych zawartych w herbacie. Umożliwia to wykonanie opisanego doświadczenia. Mechanizm reakcji jest stosunkowo skomplikowany i w uproszczeniu przedstawia go schemat widoczny na Rys.4 [5].
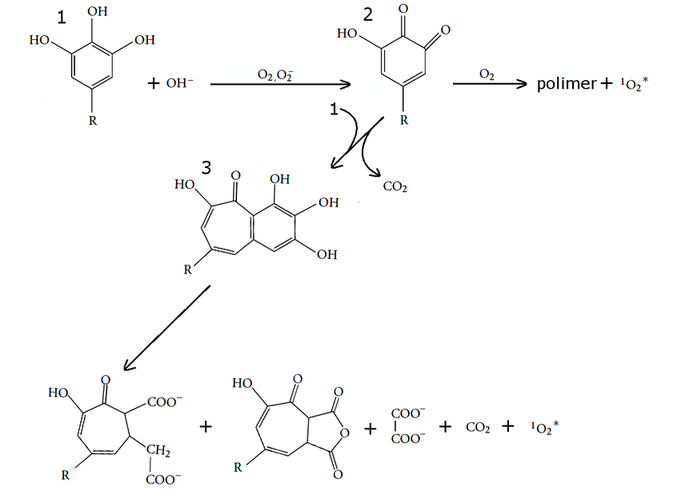
Polifenol 1, którym może być np. pirogalol (R=H) lub inny związek polifenolowy jak choćby kwas galusowy (R = COOH) w alkalicznych warunkach w obecności aldehydu mrówkowego zostaje utleniony do odpowiedniego ortochinonu 2. Dalej reakcja może biec dwoma odmiennymi szlakami: ortochinon w obecności tlenu szybko polimeryzuje lub reaguje z kolejną cząsteczką związku wyjściowego. W przypadku pirogalolu powstaje wtedy purpurogalina 3, która w warunkach reakcji ulega rozkładowi.
Za wydzielanie się dwutlenku węgla może odpowiadać także biegnąca równolegle reakcja zachodząca według poniższego równania [1]:
Wyjaśnienie to może być jednak niepełne, ponieważ istnieją doniesienia, że powstająca mieszanina gazów obok dwutlenku węgla i aldehydu mrówkowego zawiera także wodór [6].
Z naszego punktu widzenia najważniejsze jest to, że jednym z produktów obu szlaków reakcji jest tlen singletowy 1O2.
Stanem podstawowym tlenu O2 jest stan trypletowy 3O2 o dwóch niesparowanych elektronach (rodnik). Jest to więc sytuacja dosyć nietypowa. Tlen singletowy 1O2, jako występujący w stanie o wyższej energii jest nietrwały i może ulegać spontanicznemu przekształceniu do tlenu trypletowego 3O2. Różnica energii, równa 94,3kJ/mol musi więc zostać oddana do środowiska. Tutaj dzieje się to na sposób emisji promieniowania elektromagnetycznego o długości fali λ=1270nm. Promieniowanie to leży w zakresie podczerwieni i jako takie nie jest widzialne dla naszych oczu. W czasie doświadczenia koncentracja powstającego tlenu singletowego jest jednak na tyle duża, że w momentach zderzeń dwóch jego cząsteczek dochodzi do emisji fali elektromagnetycznej o długości λ=634nm. Takie promieniowanie jest już doskonale widoczne jako światło o pięknej, czerwonej barwie, co właśnie obserwujemy w doświadczeniu [7].
Oczywiście istnieją także inne metody otrzymywania tlenu w stanie singletowym. Najczęściej polecaną w literaturze, przynajmniej jeśli chodzi o działania pokazowe, jest przepuszczanie gazowego chloru przez schłodzony, alkaliczny roztwór 30% nadtlenku wodoru [8]. Sposób ten jest jednak dosyć problematyczny z racji wykorzystania silnie toksycznego gazu, a także żrącego roztworu nadtlenku. Jak się wydaje, wygodniejszą metodą jest wykorzystanie dichloroizocyjanuranu sodu, co pozwala na uniknięcie stosowania wolnego chloru [9].
Opisana w niniejszej pracy metoda uzyskiwania tlenu singletowego i jego chemiluminescencji nie wymaga stosowania silnie toksycznych substancji, ani stężonego nadtlenku wodoru. Zastosowanie łatwych do zdobycia i bezpiecznych surowców (herbata, apteczna woda utleniona) predysponuje ten sposób do zastosowania w praktyce szkolnej czy uczelnianej, a także na wszelkiego rodzaju pokazach naukowych.
Myślę, że Czytelnikowi należy się tutaj wyjaśnienie, dlaczego w doświadczeniu nie można wykorzystać czarnej herbaty jako najczęściej spożywanej w naszym kręgu kulturowym. Dzieje się tak, ponieważ w procesie produkcji tego rodzaju herbaty jej liście są poddawane m.in. fermentacji, podczas której zawarte w niej polifenole ulegają w dużej mierze utlenieniu. Z tych powodów w przypadku jej wykorzystania nie zaobserwowalibyśmy chemiluminescencji.
Literatura:
- [1] Panzarasa G., Sparnacci K., Glowing Teacup Demonstration: Trautz−Schorigin Reaction of Natural Polyphenols, Journal of Chemical Education, 2012, 89, str. 1297-1300, powrót
- [2] Trautz M., Über neue Lumineszenzerscheinungen, Zeitschrift für wissenschaftliche photographie, photophysik und photochemie, 1904, 2, str. 217-223, powrót
- [3] Quideau S. P., Deffieux D., Douat-Casassus C. L., Pouységu L., Plant Polyphenols: Chemical Properties, Biological Activities, and Synthesis, Angewandte Chemie International Edition, 2011, 50 (3), powrót
- [4] Łuczaj W., Metody oznaczania polifenoli (katechin oraz teaflawin) występujących w herbatach, Gazeta Farmaceutyczna, 2008, 5, powrót
- [5] Evmiridis N. P., Vlessidis A. G., Thanasoulias N. C., Chemical Analysis through CL-Detection Assisted by Periodate Oxidation, Bioinorganic Chemistry and Applications, 2007, powrót
- [6] Pluciński T., Doświadczenia chemiczne, 1997, Wydawnictwo Adamantan, str. 28-29, powrót
- [7] Laingl M., The Three Forms of Molecular Oxygen, Journal of Chemical Education, 1989, 66 (6), str. 453-455, powrót
- [8] Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, 2001, str. 161-163, powrót
- [9] Ples M., Światło z retorty, Chemia w Szkole, Agencja AS Józef Szewczyk, 2014, 5, str. 33-34. powrót
Marek Ples




