Zegar jodowy
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (4/2023):

Biologia, jak wiele innych nauk przyrodniczych, jest dyscypliną o charakterze doświadczalnym, w której eksperymenty odgrywają kluczową rolę w procesie nauki. W świecie biologii, poznanie teorii to tylko początek przygodya, a prawdziwe zrozumienie i odkrycie zachodzących procesów wymaga wkroczenia w świat eksperymentów.
Wiedza naukowa, szczególnie w dziedzinie biologii, ma nieocenione znaczenie zarówno dla młodych ludzi, jak i dla dorosłych, którzy z nich wyrosną. Dla młodych ludzi, nauka biologiczna jest kluczem do odkrywania tajemnic przyrody, rozumienia jej zjawisk i kształtowania świadomości ekologicznej. Przez eksperymenty, uczniowie doświadczają fascynacji odkrywaniem, a ich umiejętność analitycznego myślenia i logicznego rozumowania rozwija się, otwierając drzwi do przyszłej kariery naukowej lub świadomego podejścia do świata.
Dla dorosłych z kolei – czyli także uczniów, tyle, że później - biologia i eksperymenty mogą być źródłem ciągłego rozwoju i satysfakcji. Pogłębianie wiedzy przyrodniczej pozwala lepiej zrozumieć świat, w którym żyjemy, a także angażować się w społeczność naukową, podejmować odpowiedzialne decyzje dotyczące środowiska naturalnego i zdrowia. Eksperymenty stanowią klucz do rozwoju umiejętności rozwiązywania problemów kreatywności i elastyczności myślenia.

Opisane doświadczenie doskonale łączy dziedziny chemii i biologii, np. poprzez wykorzystanie naturalnie wystepujących substancji takich jak skrobia.
Prosto, ale efektownie!
Zegar jodowy, to jedno z tych doświadczeń chemicznych, które wspaniale bawią i zafascynują zarówno uczniów na lekcjach chemii, jak i publiczność na pokazach naukowych. Jego wykonanie jest niezwykle proste, nie wymaga trudno dostępnych substancji chemicznych, a rezultat jest naprawdę zaskakujący, zarówno pod względem wizualnym, jak i dalej idących przemyśleń [1].
Zegar jodowy należy do rodziny reakcji zegarowych, które wykorzystują sprzężenie dwóch równoległych reakcji: szybkiej i powolnej. Główną atrakcją tego doświadczenia jest zmiana barwy roztworu, która następuje nagle po upływie pewnego określonego czasu [2].
Czego potrzebujemy?
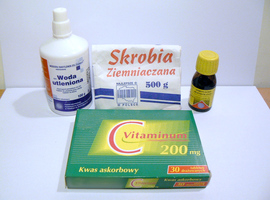
Wszystkie potrzebne substancje chemiczne są łatwo dostępne:
- skrobia ziemniaczana,
- jodyna,
- nadtlenek wodoru H2O2 3% (woda utleniona),
- kwas askorbinowy C6H8O6 (witamina C).
Wszystkie potrzebne substancje można zobaczyć na Fot.1.
Co prawda, w tym doświadczeniu nie występują żadne silnie trujące chemikalia, jednak należy zachować ostrożność jak zawsze przy pracy z substancjami chemicznymi. W przypadku jodyny należy zachować ostrożność, ponieważ plamy jodu są trudne do usunięcia. Warto stosować odpowiednie środki ochronne, m.in. fartuch laboratoryjny i rękawiczki jednorazowe.
Należy przygotować roztwór kwasu askorbinowego przez rozpuszczenie jednej tabletki (100mg) w około 25cm3 wody destylowanej. Skrobia nie rozpuszcza się w zimnej wodzie; niewielką jej ilość należy rozprowadzić we wrzątku, a potem rozcieńczyć powstały kleik skrobiowy zimną wodą. Przygotowane roztwory jest wygodnie przelać do odpowiednich buteleczek, np. z tworzywa sztucznego (Fot.2).
Zaczynamy pokaz
W czasie pokazu musimy wykonać czynności w określonej kolejności, której zachowanie jest bardzo ważne. Pierwszą rzeczą jaką musimy zrobić, jest wlanie do naczynia kilku kropli jodyny, czyli alkoholowego roztworu roztworu jodu I2, a jonów trójjodkowych I3- (fot. 3A). Jodyna jest ciemnoczerwoną, brunatną cieczą o charakterystycznym zapachu.
Następnie do roztworu dodajemy powoli po kropli roztwór witaminy C, za każdym razem mieszając. W pewnym momencie dochodzi do odbarwienia roztworu (Fot.3B). W tym momencie dodajemy jeszcze kilka kropli witaminy, uważając jednak, by ten nadmiar nie był zbyt duży. Kolejnymi substancjami jakie umieścimy w naczyniu jest kilka kropli roztworu skrobi i tyle wody destylowanej, aby rozcieńczyć roztwór dwukrotnie. Następnie do roztworu wlewamy około 10cm3 (dokładną objętość warto dobrać doświadczalnie) aptecznej wody utlenionej i szybko mieszamy. Cały roztwór w tym momencie jest całkowicie bezbarwny i klarowny (Fot.4).
Po wymieszaniu wszystkich substancji musimy się śpieszyć. Najlepiej roztwór jest rozlać do co najmniej dwóch różnych naczyń (Fot.5).
Nawet duża widownia może w tym momencie zaobserwować, że roztwór jest całkowicie bezbarwny. Jednak po niedługim czasie (zwykle kilkadziesiąt sekund, tym dłuższym, im więcej witaminy C dodaliśmy) cały roztwór w okamgnieniu zmienia barwę na granatowo-czarną i to we wszystkich naczyniacj w tym samym czasie lub prawie jednocześnie. Jest to bardzo widowiskowe i często powoduje wręcz okrzyk zdziwienia u obserwatorów (Fot.6).
Wyjaśnienie
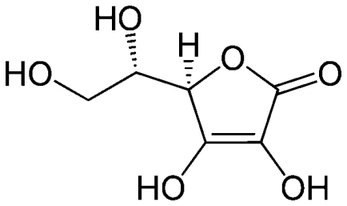
By wyjaśnić mechanizm obserwowanej reakcji musimy wspomnieć parę słów o kwasie askorbinowym czyli witaminie C. Jest to organiczny związek chemiczny będący pochodną glukozy o wzorze sumarycznym C6H8O6i strukturze przedstawionej na Rys.1.
Jodyna zawdzięcza swoją brunatną barwę rozpuszczonemu w niej jodowi. Dzięki dodatkowi kwasu askorbinowego jod zostaje zredukowany do jonów jodkowych, które nie dają w roztworze żadnej barwy (następuje odbarwienie). Redukcja jodu jest zjawiskiem powolnym. Nadtlenek wodoru ma działanie przeciwne: szybko utlenia jodki do wolnego jodu. Zauważmy, że jest to jednak możliwe dopiero po wyczerpaniu zapasu kwasu askorbinowego. Właśnie to jest odpowiedzialne za opóźnienie wystąpienia zmiany barwy. W momencie wyczerpania w roztworze kwasu askorbinowego dochodzi do gwałtownego utlenienia jodków. W roztworze pojawia się stosunkowo duża ilość wolnego jodu, który wiążąc się ze skrobią daje ciemnogranatowe zabarwienie [3] [4].
Długość oczekiwania na zabarwienie się roztworu można regulować w szerokim zakresie przez modyfikację ilości dodanego kwasu askorbinowego.
Ten prosty, ale niezwykle efektowny eksperyment ma wiele zastosowań. Zegar jodowy może być wykorzystywany do demonstracji kinetyki chemicznej, czyli badania szybkości reakcji i czynników mających na nią wpływ. Może też stanowić doskonały przykład do omówienia pojęć równowagi chemicznej. Pamiętajmy, że pojęcia te mają wielkie znaczenie także w analizie procesów chemicznych zachodzących w żywych organizmach.
Zegar jodowy to kolejny dowód na to, jak nauka może być nie tylko fascynująca, ale i piękna. To połączenie precyzji chemicznej i wizualnego efektu sprawia, że opisane doświadczenie przyciąga uwagę zarówno już zdeklarowanych pasjonatów biologii i biochemii, jak i tych, którzy dopiero odkrywają jej tajemnice. Czyż nie jest to wspaniała ilustracja potęgi i piękna nauki?
Literatura:
- [1] Landolt H., Ueber die Zeitdauer der Reaction zwischen Jodsäure und schwefliger Säure, Berichte der deutschen chemischen Gesellschaft, 19 (1), 1886, str. 1317-1365 powrót
- [2] Oliveira A. P., Faria R. B., The chlorate-iodine clock reaction, Journal of the American Chemical Society, 127 (51), 2005, str. 18022-18023 powrót
- [3] Wright S. W., The vitamin C clock reaction, Journal of Chemical Education, 79 (1), 2002, str. 41 powrót
- [4] Wright S. W., Tick Tock, a Vitamin C Clock, Journal of Chemical Education, 79 (1), 2002, str. 40A powrót
Autorem fotografii i rysunków jest Marek Ples.
Uzupełnienie autora
Efekt doświadczenia można zobaczyć na filmie:
Marek Ples