Czy to jest krew?
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (2/2022):

Zatrzymajmy się na chwilę przy naszej podręcznej bibliotece. Bez względu na to, czy kryminały są one naszym ulubionym gatunkiem literackim czy też nie, książki Agathy Christie są - moim skromnym zdaniem - poza wszelką krytyką [1]. Nieodżałowany Herkules Poirot w jednej z nich stwierdza, że:
Zabójstwo pozostaje zabójstwem bez względu na to, czy je popełniono wczoraj, czy przed szesnastu laty.
Nie można odmówić temu racji. Skąd jednak możemy wiedzieć, czy rzeczywiście doszło do morderstwa, czy może zaistniał tylko nieszczęśliwy wypadek? Wtedy rozpoczyna się śledztwo…
Jedną z najważniejszych spraw jest stwierdzenie obecności krwi na miejscu zbrodni, na przedmiotach mogących być jej narzędziami, albo należących do podejrzanego. Współczesny śledczy ma jednak w zanadrzu więcej pomocnych metod niż mógłby śnić bohater z kart powieści Pani Christie. Jedną z nich jest technika wykrywania obecności nawet bardzo małych ilości krwi oparta na właściwościach chemiluminescencyjnych specyficznych substancji.
Doświadczenie
Chemiluminescencję możemy określić jako zjawisko, podczas którego dochodzi do emisji promieniowania elektromagnetycznego - głównie z zakresu światła widzialnego, ale wiele definicji dopuszcza tu także promieniowanie nadfioletowe i podczerwone - w wyniku specyficznych reakcji chemicznych. Powstające wtedy produkty istnieją w termodynamicznie nietrwałym stanie wzbudzonym, by przejść następnie do stanu podstawowego o niższej energii, a jej różnica jest oddawana do środowiska (bezpośrednio lub za pośrednictwem innych molekuł) w formie światła [2].
Wiele substancji wykazuje zdolność do chemiluminescencji, między innymi lucyferyna z lucyferazą (co wykorzystują na przykład chrząszcze z rodziny świetlikowatych Lampyridae), biały fosfor, singletowa odmiana tlenu, lofina, układ pirogalol-formaldehyd, polifenole z zielonej herbaty, siloksen Wöhlera będacy ciekawym związkiem krzemoorganicznym i wiele innych.
Wydajnym chemiluminoforem jest luminol C8H7N3O2, czyli hydrazyd kwasu 3-aminoftalowego (Rys.1). Luminol w warunkach normalnych ma zwykle postać drobnokrystalicznego proszku, o barwie od kremowej, przez żółtawą aż do jasnobrązowej [3].
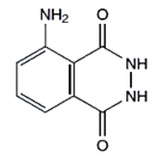
Co ciekawe, w odpowiednich warunkach luminol może umożliwiać wykrycie nawet bardzo niewielkich ilości krwi, czy raczej zawartego w erytrocytach czerwonego barwnika oddechowego, jakim jest hemoglobina.
Aby przygotować odczynnik pozwalający na wykrywanie krwi potrzebujemy jeszcze jedynie wodorotlenek potasu KOH (lub sodu NaOH) i nadtlenku wodoru H2O2 o stężeniu 3%, czyli najzwyklejszej wody utlenionej dostępnej w aptekach.
Przystępując do doświadczenia musimy w objętości około 20cm3 wody destylowanej rozpuścić kilka granulek wodorotlenku potasu – ilość nie jest krytyczna. Następnie do zalkalizowanego roztworu dodajemy odrobinę luminolu – porównanie z łebkiem od zapałki niech będzie wskazówką jak niewielka ilość tej substancji jest potrzebna (Fot.1).
Warto zaznaczyć, że luminol bardzo słabo rozpuszcza się w czystej wodzie, a znacznie lepiej w roztworze zasady. Do roztworu dodajemy następnie 5cm3 nadtlenku wodoru w postaci wody utlenionej. Gotowy odczynnik jest prawie bezbarwny, ma jedynie bardzo delikatny żółty odcień (Fot.2).
Tak przygotowany odczynnik jest niestety nietrwały i musi zostać dosyć szybko zużyty – najlepiej w ciągu maksymalnie kilku godzin. Alkaliczny roztwór luminolu możemy przechowywać dłużej w ciemności i w lodówce, ale w takim przypadku nadtlenek wodoru musimy do niego dodać bezpośrednio przed wykorzystaniem.
Chcąc wypróbować odczynnik natrafiamy na problem, ponieważ jest w tym celu potrzebna krew. Chciałbym w tym miejscu przestrzec przed wykorzystaniem nawet niewielkich próbek krwi o nieznanym pochodzeniu, ponieważ mogą one stanowić czynnik zakaźny. Dobrym i bezpiecznym sposobem jest wykorzystanie suszonej krwi zwierzęcej - np. wieprzowej – dostępnej w handlu i wykorzystywanej np. przez wędkarzy do zanęcania ryb. Fotografia 3 przedstawia wyizolowaną i suszoną hemoglobinę bydlęcą wykorzystaną w moich doświadczeniach.
Przelejmy nieco naszego odczynnika do niewielkiej zlewki i dodajmy do niego kroplę krwi lub szczyptę suchego preparatu (krwi suszonej lub izolatu hemoglobiny). Jak widać na Fot.4A izolat unosi się na powierzchni płynu – możemy jedynie zauważyć delikatne pienienie się roztworu z powodu wywiązywania się tlenu w wyniku rozkładu nadtlenku wodoru.
W ciemności jednak z łatwością zauważymy, że roztwór w kontakcie z substancją zawierającą hemoglobinę zaczyna wyraźnie świecić na piękny, niebieski kolor (Fot.4B). Jeśli płyn zamieszać, to efekt staje się jeszcze bardziej widowiskowy, ponieważ cała objętość roztworu rozbłyskuje jasnym światłem (Fot.5).
Opisaną reakcję rzeczywiście wykorzystuje się jako wstępny test obecności krwi na miejscu domniemanej zbrodni lub w odniesieniu do konkretnych narzędzi. Robi się to przez spryskanie roztworem obszaru lub przedmiotu będącego obiektem zainteresowania. Obserwacji nie dokonuje się gołym okiem z racji faktu, że emitowane sygnały świetlne mogą być zbyt słabe – pomocą są tu fotografie o wydłużonym czasie naświetlania.
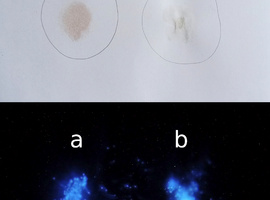
Opisana metoda ma jednak wiele ograniczeń. Aby poznać jedno z nich, a także sposób jak je przezwyciężyć, musimy przygotować prostą symulację sytuacji z miejsca zbrodni. W tym celu na kartce czystego papieru w określonym miejscu rozetrzyjmy nieco świeżej lub suszonej krwi, albo izolatu hemoglobiny, a tuż obok np. nieco płynu wyciśniętego z korzenia pietruszki zwyczajnej Petroselinum crispum lub chrzanu pospolitego Armoracia rusticana. Papier należy potem wysuszyć w temperaturze pokojowej, najlepiej dala od bezpośredniego oświetlenia światłem słonecznym. Oba miejsca na kartce oznaczmy za pomocą okręgu narysowanego ołówkiem, jak to widać na Fot.6.
Jak widać, po spryskaniu roztworem odczynnika w ciemności możemy zauważyć, że rzeczywiście plama roztwartej krwi (hemoglobiny) zaczyna świecić. Co ciekawe, okazuje się, że także substancje chemiczne zawarte w wyciągu z korzenia pietruszki mają taką samą właściwość katalizowania reakcji chemiluminescencji luminolu. Niestety, chemiluminescencji powodowanej przez składniki krwi nie można odróżnić w ten prosty sposób od świecenia na skutek kontaktu z wieloma wyciągami roślinnymi, które z różnych względów mogą być obecne prawie wszędzie.
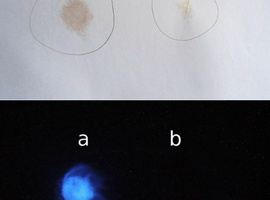
Sprawdźmy jednak, jaki wpływ na doświadczenie wywrze podwyższona temperatura. Drugi przygotowany w taki sam sposób arkusz papieru z naniesionymi plamami interesujących nas substancji wysuszmy w podwyższonej (do co najmniej 60°C) temperaturze, np. poprzez prasowanie żelazkiem, a następnie spryskajmy odczynnikiem jak poprzednio (Fot.7).
Zauważmy, że w wyniku traktowania podwyższoną temperaturą plama wyciągu roślinnego straciła zdolność do wywoływania świecenia odczynnika, natomiast plama z roztartej krwi ją zachowała. Jak więc widzimy, podgrzanie próbek pozwala na eliminację fałszywie pozytywnych wyników pochodzących od wyciągów roślinnych.
Dodatkowo, musimy pamiętać, że test z wykorzystaniem odczynnika luminolowego jest niszczący, to znaczy próbek, na których go przeprowadzono nie możemy zastosować w dalszych analizach. Ze względu na ograniczenia należy opisany test traktować jako metodę wstępną lub wspomagającą.
Wyjaśnienie
Mechanizm reakcji polega na utlenianiu luminolu w środowisku zasadowym w obecności katalizatora. W zasadowym roztworze luminol dysocjuje do postaci dwuujemnego anionu. W wyniku tautomeryzacji keto-enolowej powstają dwie różniące się budową i rozmieszczeniem ładunku ujemnego formy: ketonowa, gdzie ładunek ujemny jest zlokalizowany na atomach azotu, oraz enolowa, z ładunkiem zgromadzonym na atomach tlenu. Dalszej reakcji ulega forma enolowa. Zostaje ona utleniona w środowisku alkalicznym przez nadtlenek wodoru, czego produktem jest cykliczny nadtlenek. Z racji istnienia w jego strukturze mostku nadtlenkowego to indywiduum chemiczne jest wysoce nietrwałe, przez co dochodzi szybko do jego spontanicznego rozpadu, czego produktem jest cząsteczka azotu oraz 3-aminoftalan. Co ważne, ten ostatni związek powstaje w stanie wzbudzonym, który przechodzi do stanu podstawowego. Zgodnie z zasadą zachowania nadwyżka energii zostaje wypromieniowana do środowiska pod postacią światła, tutaj niebieskiego.
Katalizatorem reakcji mogą być różnego rodzaju związki kompleksowe np. żelaza. W wielu doświadczeniach z luminolem jako katalizator reakcji stosuje się heksacyjanożelazian(III) potasu K3[Fe(CN)6], lecz jest on oczywiście nieobecny we krwi.
W przypadku krwi katalizatorem opisywanej reakcji jest hemoglobina. Składa się ona z części białkowej – globiny - oraz prostetycznego hemu o strukturze zbliżonej do porfiryn (rys. 2) [4]. W cząsteczce hemu odpowiednia porfiryna posiada kation żelaza unieruchomiony przez cztery wiązania żelazo-azot. Formalnie dwa z nich to wiązania kowalencyjne, a dwa koordynacyjne, choć w rzeczywistości są one równocenne.
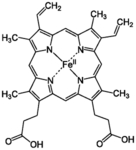
Trzeba zaznaczyć, że podobną reakcję dają liczne roślinne enzymy, na przykład peroksydazy występujące w korzeniu chrzanu lub pietruszki. Są to oczywiście białka, więc działanie wysoką temperaturą powoduje ich denaturację i utratę zdolności katalitycznej. Hem, jako komponent niebiałkowy jest bardziej odporny na podwyższoną temperaturę i dzięki temu możemy wykonać test różnicujący.
Literatura:
- [1] Hart A., Herkules Poirot – życie i czasy (biografia według Agathy Christie), Prószyński i S-ka, 1998 powrót
- [2] Ples M., Fiolet świeci - chemiluminescencja powszechnie dostępnego związku manganu, Chemia w Szkole, 6 (2018), Agencja AS Józef Szewczyk, 16-19 powrót
- [3] Huntress E., Stanley L., Parker A., The Preparation of 3-Aminophthalhydrazide for Use in the Demonstration of Chemiluminescence, Journal of the American Chemical Society, 56(1), 1934, str. 241–242 powrót
- [4] Solomon E. P., Berg L. R, Martin D. W., Villee C. A., Biologia, Multico Oficyna Wydawnicza, Warszawa, 1996, str. 68 powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples