Błyskotliwa reakcja zegarowa
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (5/2019):

Kinetyka chemiczna jest działem chemii fizycznej zajmującym się badaniem przebiegu reakcji chemicznych w czasie. Przedmiotem zainteresowania kinetyki są więc takie aspekty związane z zachodzeniem procesów chemicznych, jak ich szybkość, wpływ różnorodnych czynników, a także w ogólności samym przebiegiem reakcji. Aby poznać kinetykę danej reakcji chemicznej musimy zbadać zależności łączące szybkość powstawania produktów (lub ubywania substratów) z takimi czynnikami jak np. początkowe stężenia substratów, ciśnienie, temperatura, wykorzystany rozpuszczalnik, rodzaj i koncentracja katalizatora.
Określenie postaci równania kinetycznego reakcji chemicznej i wyznaczenie wchodzących w jego skład współczynników może być pomocne w poznaniu mechanizmu tej reakcji.
O ile głębsze rozważania na temat kinetyki chemicznej leżą poza programem szkolnym, to możemy jednak wykonać pewne doświadczenia w temacie interesujących z tego punktu widzenia tzw. reakcji zegarowych, nazywanych też często zegarami chemicznymi. Są to reakcje, w których obserwowany efekt jest odsunięty w czasie (w przypadku odpowiedniego przygotowania opóźnienie można dosyć dokładnie określić) od momentu uruchomienia układu reakcyjnego, np. przez zmieszanie roztworów reagentów. Dosyć znaną tego typu reakcją jest reakcja Landolta, w której bezbarwny początkowo roztwór po pewnym czasie zmienia nagle kolor na ciemnogranatowy, prawie czarny, spowodowany powstaniem kompleksu jodu ze skrobią. Proste reakcje tego typu, choćby tzw. apteczną reakcję zegarową (z wykorzystaniem łatwo dostępnych, tanich i nietoksycznych surowców) można z łatwością przeprowadzić na zajęciach szkolnych - czy to w czasie lekcji, czy na kole przedmiotowym [1].

Specyficzny przykład reakcji zegarowej stanowił temat jednego z zadań przygotowanych dla uczestników 50 Międzynarodowej Olimpiady Chemicznej (Bratysława – Praga, 19-29.07.2018). W niniejszym artykule chciałbym przedstawić sprawdzoną w praktyce wersję tego doświadczenia, która została przystosowana do warunków szkolnej pracowni chemicznej.
Doświadczenie
W opisywanym doświadczeniu wykorzystałem następujące substancje:
- L-cysteina, w postaci monohydratu chlorowodorku C3H7NO2S·HCl·H2O,
- luminol (hydrazyd kwasu 3-aminoftalowego) C8H7N3O2,
- siarczan(VI) miedzi(II), w postaci pentahydratu CuSO4·5H2O,
- wodorotlenek potasu KOH, ewentualnie wodorotlenek sodu NaOH,
- nadtlenek wodoru H2O2 (o stężeniu 3%).
Cysteina jest związkiem chemicznym z grupy kodowanych w materiale genetycznym aminokwasów endogennych budujących białka wchodzące w skład naszego organizmu. Aminokwasy są grupą związków organicznych zawierających w swoich cząsteczkach zasadową grupę aminową oraz kwasową grupę karboksylową −COOH lub - mówiąc bardziej ogólnie - dowolną grupę kwasową [2].
Cysteina wchodzi w skład wielu białek. Wraz z homocysteiną C4H9NO2S i metioniną C5H11NO2S należy do grupy aminokwasów siarkowych, to znaczy zawierających w swojej cząsteczce atom lub atomy siarki [3].
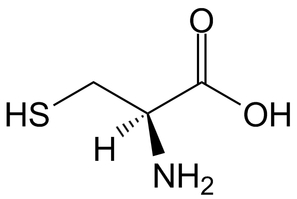
W budowie cząsteczki cysteiny występuje grupa tiolowa –SH. Z powodu obecności tej grupy przy trzecim atomie węgla centrum stereogeniczne cząsteczki przyjmuje konfigurację R dla spotykanego w naturze izomeru szeregu L, czyli L-cysteiny. Pozostałe aminokwasy występujące naturalnie w białkach posiadają konfigurację S. Cysteina jest więc jedynym spośród naturalnych L-aminokwasów białkowych o odmiennej budowie cząsteczki, przynajmniej w tym aspekcie.
W warunkach normalnych zarówno wolna cysteina, jak i wykorzystany w doświadczeniu chlorowodorek jest krystalicznym ciałem stałym o barwie białej (Fot.1).
Wzór strukturalny L-cysteiny przedstawia Rys.1.
Luminol jest organicznym związkiem heterocyklicznym, posiadającym dwa atomy azotu w obrębie pierścienia. Utleniany w odpowiednich warunkach wykazuje zdolność do chemiluminescencji, tzn. emisji promieniowania elektromagnetycznego z zakresu światła widzialnego kosztem energii chemicznej [4]. Luminol występuje w postaci proszku barwy żółtej do brązowej (Fot.2).
Chemiluminescencja luminolu w środowisku wodnym wymaga odpowiedniego katalizatora. Jego rolę mogą pełnić dwudodatnie kationy miedzi Cu2+, których donorem w doświadczeniu jest pentahydrat siarczanu(VI) miedzi(II), nazywany dawniej witriolem miedzi lub sinym kamieniem. Związek ten formuje niebieskie kryształy (Fot.3). W naturze wspomniana sól występuje w postaci minerału chalkantytu.
Wykorzystanie wodorotlenku potasu lub sodu ma za zadanie wytworzyć zasadowe środowisko konieczne w przypadku reakcji chemiluminescencji luminolu, a nadtlenek wodoru stanowi utleniacz (można tutaj wykorzystać apteczną wodę utlenioną).
Należy pamiętać, że chociaż L-cysteina jest substancją, bez której trudno wyobrazić sobie życie, to należy z nią postępować ostrożnie, jak z każdą – nawet niezbyt szkodliwą - substancją chemiczną. Może mieć ona działanie drażniące, a ekspozycja zwiększona ponad poziom naturalny może powodować negatywne skutki zdrowotne. Toksyczność luminolu nie została dokładnie zbadana, ma on jednak działanie drażniące na nasz organizm i jest nawet podejrzewany o posiadanie właściwości rakotwórczych. Siarczan(VI) miedzi(II) jest toksyczny i należy unikać bezpośredniego kontaktu tej substancji z naszym organizmem. Nie można też zapominać, że wodne roztwory wodorotlenków potasu oraz sodu są silnie żrące i mogą powodować poważne uszkodzenia ciała – szczególnie trzeba chronić oczy. Nadtlenek wodoru przy stężeniu 3% nie wykazuje silnego działania żrącego, ale jego bardziej stężone roztwory w kontakcie ze skórą lub innymi tkankami mogą powodować bolesne i trudno gojące się zmiany martwicze. Eksperymentując nie zapominajmy więc o niebezpieczeństwach wynikających z niedbałego podejścia lub pośpiechu i zawsze stosujmy odpowiednie środki ochrony osobistej.
Przystępując do przeprowadzenia doświadczenia musimy sporządzić trzy roztwory podstawowe według przepisu, stosując we wszystkich przypadkach wyłącznie wodę destylowaną:
- A - 0,8g jednowodnego chlorowodorku L-cysteiny w 50cm3 wody,
- B - 5g wodorotlenku potasu (lub odpowiednia ilość wodorotlenku sodu), a następnie 0,2g luminolu w 100cm3 wody,
- C - 0,3g pięciowodnego siarczanu(VI) miedzi (II) w 100cm3 wody, następnie pobrać 10cm3 tego roztworu i rozcieńczyć do objętości 100cm3 [5].
Roztwory najlepiej sporządzać bezpośrednio przed przeprowadzeniem doświadczenia, ponieważ w szczególności roztwór A jest nietrwały. W mniejszym stopniu dotyczy to także roztworu B.
W przypadku roztworu B dosyć ważne jest, aby w podanej objętości wody rozpuścić najpierw podaną ilość wodorotlenku, a dopiero potem dodać luminol. Jest tak dlatego, ponieważ chemiluminofor bardzo opornie rozpuszcza się w czystej wodzie, a dużo lepiej w roztworze o odczynie zasadowym.
Pozornie skomplikowane przygotowanie roztworu C jest spowodowane faktem, że wymagane stężenie soli miedzi jest rzędu jednej dziesięciotysięcznej części mola na decymetr sześcienny. Sporządzając roztwór bezpośrednio musielibyśmy dysponować bardzo dokładną wagą. Odpowiednio go rozcieńczając zmniejszamy wprawdzie dokładność przygotowania, ale możliwe staje się odważenie potrzebnej ilości substancji na łatwiej dostępnych i mniej dokładnych wagach.
Mając gotowe roztwory podstawowe możemy przystąpić do przeprowadzenia doświadczenia, sporządzając w dwóch naczyniach roztwory:
- r-r 1 - 1cm3 roztworu A zmieszać z 5cm3 roztworu B,
- r-r 2 - do 10cm3 roztworu C dodać 2cm3 wody i 12-15 kropli nadtlenku wodoru 3%.
Powstałe w ten sposób roztwory są bezbarwne (Fot.4).
Po zmieszaniu obu cieczy roztwór przyjmuje barwę brunatną (Fot.5). Przez cały czas doświadczenia przydatne jest intensywne mieszanie, np. za pomocą mieszadła magnetycznego.
Mieszając roztwór mamy wrażenie, że nic szczególnego się nie dzieje. Dopiero potem, nagle po pewnym czasie (zwykle kilkanaście-kilkadziesiąt sekund), ciecz nagle zmienia barwę. Możemy przy tym zauważyć czasem mniejsze lub większe pienienie się (szczególnie w wypadku dodania większej ilości nadtlenku wodoru) i chwilowe wystąpienie barwy niebieskawej (Fot.6).
Po reakcji zawartość naczynia przyjmuje odmienną, nieco jaśniejszą niż początkowo, barwę (Fot.7).
Obserwacje przekonują nas, że mamy do czynienia z reakcją zegarową, ponieważ początkowo nie obserwujemy żadnych zmian, a na dosyć nagły efekt musimy poczekać pewien czas. Odmienność tej reakcji w stosunku do innych reakcji zegarowych, w których obserwowanym efektem jest jedynie zmianą barwy roztworu stanowi właśnie ów pojawiający się na krótko (vide Fot.6), ledwie uchwytny niebieskawy odcień. Jeśli będziemy obserwować zachodzącą reakcję w ciemności, to zauważymy, że właśnie w tym momencie dochodzi do silnej, ale krótkotrwałej chemiluminescencji, która może być czasem zaobserwowana nawet w niezaciemnionym pomieszczeniu właśnie jako delikatne zabarwienie niebieskie. Porównanie widoku reakcji zachodzącej na świetle i w ciemności ukazuje sekwencja zdjęć przedstawiona na Fot.8.
Jak widzimy, reakcji towarzyszy opóźniony w czasie błysk światła powstały w wyniku utleniania luminolu. Efekt jest widowiskowy, szczególnie jeśli doświadczenie przeprowadza się w większej skali. Przygotowując szereg naczyń z roztworem 1 i dodając do nich kolejno roztwór 2 można uzyskać wspaniały efekt kaskady następujących po sobie chemicznych rozbłysków.
Wyjaśnienie
Jak wcześniej wspomniano, rolę katalizatora chemiluminescencyjnej reakcji utleniania luminolu nadltenkiem wodoru w środowisku alkalicznym mogą pełnić kationy miedzi(II). Początkowo jednak w roztworze jony te zostają związane w kompleksie z cysteiną w myśl równania reakcji (cysteina została zapisana symbolicznie jako R-SH, dla wyeksponowania ważnej z naszego punktu widzenia grupy tiolowej):
Kompleks miedzi z cysteiną nie posiada zdolności do katalizowania reakcji utleniania luminolu, nie obserwujemy więc świecenia.
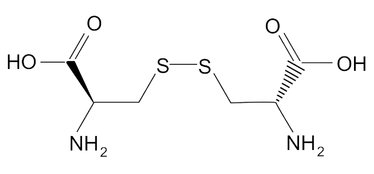
Kolejnym procesem zachodzącym w roztworze jest powolne utlenianie cysteiny nadtlenkiem wodoru do cystyny, będącej dimerem zawierającym w swojej strukturze tzw. mostek dwusiarczkowy (Rys.2).
Reakcję tę można – przy założeniu, że (RS)2 symbolizuje cystynę – zapisać jako:
Warto wspomnieć, że zdolność tworzenia przez cysteinę mostków dwusiarczkowych pełni niebagatelną rolę w formowaniu budowy przestrzennej białek, to jest ich struktury trzeciorzędowej.
Powstała cystyna nie tworzy z jonami miedziowymi kompleksu maskującego ich obecność, a więc mogą one rozwinąć swoje działanie katalityczne. Po utlenieniu więc całej cysteiny i przekształceniu jej do cystyny obserwujemy więc błysk niebieskiego światła, a często także pienienie się roztworu na skutek rozkładu pozostałego nadtlenku wodoru na wodę i tlen.
Opóźnienie wystąpienia błysku można regulować w szerokich granicach dostosowując stężenie jonów miedziowych w wyjściowym roztworze. Zwiększenie stężenia powoduje skrócenie czasu oczekiwania, zaś zmniejszenie pozwoli na jego wydłużenie (spada jednak przy tym intensywność świecenia). Duży wpływ na wspomniany czas ma także temperatura cieczy i stężenia pozostałych reagentów.
Literatura:
- [1] Ples M., Zegar jodowy, w serwisie: https://weirdscience.eu, dostępne online: http://weirdscience.eu/Zegar%20jodowy.html [dostęp: 26.09.2019] powrót
- [2] Mastalerz P., Chemia Organiczna, Wydawnictwo naukowe PWN, Warszawa, 1986 powrót
- [3] Hassa R., Mrzigod J., Podręczny słownik chemiczny (wyd. I), Videograf II, Katowice, 2004, str. 243 powrót
- [4] Ples M., Chemiluminescencja luminolu aktywowana żelazicyjankiem, w serwisie: https://weirdscience.eu, dostępne online: http://weirdscience.eu/Chemiluminescencja%20luminolu%20aktywowana%20%C5%BCelazicyjankiem.html [dostęp: 26.09.2019] powrót
- [5] Seidl M., Chemolumineszenz mit Luminol - Der blaue Blitz, w serwisie: https://www.chem-page.de/, dostępne online: https://www.chem-page.de/experimente/chemolumineszenz-mit-luminol-der-blaue-blitz.html [dostęp: 26.09.2019] powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples







