Błękitna poświata - synteza i chemiluminescencja związku Grignarda
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (6/2017):

Chemia jest jedną z nauk, które zdecydowanie przyczyniły się do kształtu dzisiejszego świata. Jeśli chodzi o zastosowania praktyczne, to bardzo ważna jest synteza organiczna, będąca jednym z działów chemii organicznej. Ta gałąź wiedzy zajmuje się przekształcaniem łatwo dostępnych i tanich związków w inne o wymaganych właściwościach. Nic więc dziwnego, że o syntezie organicznej mówi się także w aspekcie przemysłu chemicznego. Na drodze takiej syntezy powstaje wiele współczesnych leków i materiałów.
Związki magnezoorganiczne są dosyć często wykorzystywane w syntezie organicznej z racji swych przydatnych właściwości. Są to metaloorganiczne związki chemiczne zawierające co najmniej jedno wiązanie Mg–C. Odkrył je i opisał po raz pierwszy francuski chemik Victor Grignard, za co w 1912 roku otrzymał Nagrodę Nobla w dziedzinie chemii [1]. Od tego czasu związki magnezoorganiczne często nazywa się związkami Grignarda i są jednymi z najczęściej wykorzystywanych substancji metaloorganicznych.
Ogólny wzór omawianych związków przedstawia się zwykle w postaci RMgX (R - grupa alkilowa lub arylowa, X - atom pierwiastka z grupy fluorowców). Najczęściej w związkach organicznych zawierających heteroatom wiązanie między nim a węglem jest spolaryzowane w kierunku heteroatomu, ponieważ ma on większą elektroujemność. Atom węgla staje się centrum elektrofilowym, gdyż gromadzi się na nim cząstkowy ładunek dodatni. Inaczej wygląda sytuacja w związkach magnezoorganicznych - atom węgla połączony jest z atomem magnezu, który ma mniejszą elektroujemność. W takim przypadku wiązanie jest spolaryzowane w kierunku atomu węgla, który staje się centrum nukleofilowym.
Wśród wielu przydatnych i ciekawych właściwości związków magnezoorganicznych chciałbym dziś przedstawić jeszcze jedną, dosyć mało znaną. Okazuje się, że pewne związki Grignarda wykazują wyraźną chemiluminescencję. Zjawisko polega to na emisji światła kosztem energii chemicznej i zachodzi podczas specyficznych reakcji. Szeroko znana jest chemiluminescencja luminolu C8H7N3O2 i tlenu singletowego 1O2 [2] [3]. Pewne reakcje tego typu są jednak słabo znane oraz wykorzystywane w aspekcie dydaktycznym i uważane za wręcz egzotyczne. Należy tutaj wspomnieć o świeceniu zachodzącym podczas utleniania polifenoli zawartych choćby w herbacie oraz siloksenu Wöhlera Si6O3H6 - ciekawego związku krzemoorganicznego możliwego do otrzymania ze zwykłego piasku [4] [5].
Obserwacja chemiluminescencji związków magnezoorganicznych jest możliwa do przeprowadzenia nawet w średnio wyposażonym laboratorium. Najpierw jednak musimy dokonać syntezy odpowiedniej substancji.
Synteza
Otrzymywanie związków Gringarda na skalę laboratoryjną nie jest skomplikowane, ale wymaga pewnych przygotowań.
Pierwszą rzeczą, o jakiej musimy pamiętać jest to, że synteza musi odbywać się w środowisku praktycznie całkowicie bezwodnym. Odpowiednim środowiskiem reakcji będzie eter dietylowy C4H10O.
Tutaj kilka ostrzeżeń. Wspomniany eter jest skrajnie łatwopalną cieczą - jego temperatura zapłonu wynosi nieco ponad 40°C, zaś samozapłonu 180°C [6]. Z tlenem (także zawartym w powietrzu) tworzy mieszaninę wybuchową. Należy pamiętać, że pary eteru są cięższe od powietrza, opadają więc na dół i rozprzestrzeniają się po stole lub podłodze. Nie wolno więc używać żadnych źródeł otwartego ognia w pobliżu naczyń zawierających eter, ponieważ możliwe jest podpalenie jego par nawet z odległości kilku metrów! W wyniku kontaktu z powietrzem i światłem eter ma skłonność do tworzenia wybuchowych nadtlenków – należy to brać zawsze pod uwagę, szczególnie w przypadku starszych lub niewłaściwie przechowywanych próbek tej substancji. Dodatkowo eter ma właściwości nasenne i narkotyczne – nałogowe wdychanie jego par lub spożywanie jest nazywane eteromanią.
Posiadany eter należy więc przedestylować, po czym osuszyć. W tym celu powszechnie wykorzystuje się suszenie metalicznym sodem lub stopem sodu z potasem. Przy nieumiejętnym prowadzeniu tego procesu, a szczególnie przy pozbywaniu się resztek aktywnego metalu może to być dosyć niebezpieczne.
Z powyższego powodu chciałbym zaproponować wypróbowaną przeze mnie metodę alternatywną, tj. wykorzystanie sit molekularnych. Są to materiały nanoporowate. Ich cechą charakterystyczną jest to, że wymiary występujących w nich porów są dosyć ściśle określone, dzięki czemu posiadają zdolność selektywnego adsorbowania cząsteczek. Każdy rodzaj sit molekularnych posiada charakterystyczną wielkość porów oraz strukturę ich kanałów.
W praktyce laboratoryjnej wykorzystuje się często sita molekularne wytworzone w oparciu o grupę minerałów glinokrzemianowych nazywanych zeolitami. Do suszenia rozpuszczalników takich jak eter dietylowy można wykorzystać sita molekularne o oznaczeniu 4Å. Mają one zdolność adsorbcji cząsteczek o wymiarach poniżej 4 angstremów (angstrem Å to pozaukładowa jednostka długości równa 10−10m), takich jak np. woda H2O, amoniak NH3, dwutlenek węgla CO2 i inne.
Komercyjne sita molekularne 4Å mają zwykle postać granulek o średnicy około 1mm (Fot.1).
Wspomniane sita molekularne dobrze pochłaniają wilgoć z rozpuszczalników niewodnych, a także z powietrza. Przed użyciem trzeba je jednak aktywować, tj. usunąć pochłoniętą uprzednio wodę. Robi się to np. wygrzewając je w temperaturze 260°C w ciągu 1 godziny. Aktywowane sita molekularne po ostudzeniu dodaje się do suszonego rozpuszczalnika w ilości około 1/3 jego objętości (Fot.2). Pochłanianie wody wymaga nieco czasu – naczynie z sitami powinno być szczelnie zamknięte przez czas od 24 do 48 godzin.
Odwodniony eter trzeba izolować od wilgoci atmosferycznej i najlepiej wykorzystać jak najszybciej do przeprowadzenia syntezy.
Kolejną potrzebną substancją będzie metaliczny magnez. Metal powinien być w postaci drobnych wiórów, ale nie proszku (Fot.3). Muszą być one czyste, nie zatłuszczone.
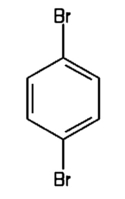
Będziemy potrzebowali także 1,4-dibromobenzenu lub inaczej p-dibromobenzenu C6H4Br2 o wzorze strukturalnym jak na Rys.1.
Omawiany związek w temperaturze pokojowej ma postać białego ciała krystalicznego o charakterystycznym zapachu (Fot.4).
W przypadku manipulacji z 1,4-dibromobenzenem jest zalecana ostrożność, ponieważ działa on drażniąco na skórę i podczas wdychania jego pyłów. Jest też silnie toksyczny dla organizmów wodnych.
Zarówno magnez, jak i 1,4-dibromobenzen muszą być podobnie jak eter pozbawione śladów wody, np. poprzez kilkudniowe przechowywanie w zamkniętym naczyniu, którego dno wysypano aktywowanymi sitami molekularnymi.
Przystępując do syntezy w kolbie okrągłodennej należy umieścić 2,4g magnezu oraz roztwór 23,6g 1,4-dibromobenzenu w 130cm3 bezwodnego eteru dietylowego (Fot.5) [7]. Ilości substratów można oczywiście skalować w odpowiedzi do własnych potrzeb.
Kolbę należy zaopatrzyć w chłodnicę zwrotną o dosyć intensywnym obiegu zimnej wody. Pamiętajmy, że środowisko reakcji musi być jak najbardziej bezwodne – z tego powodu górny wylot chłodnicy trzeba koniecznie zaopatrzyć w rurkę z substancją pochłaniającą wodę. Schemat układu reakcyjnego przedstawia Rys.2.
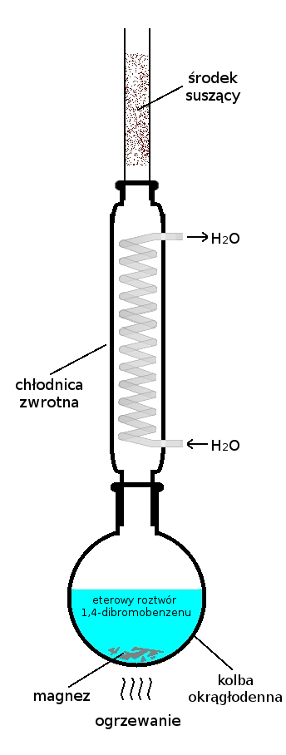
Po zestawieniu układu należy rozpocząć delikatne ogrzewanie kolby. Oczywiście nie wolno tu używać źródeł otwartego ognia! Po pewnym czasie zaczną być widoczne oznaki zachodzenia reakcji – roztwór stanie się mętny z powodu powstającego związku magnezoorganicznego.
W razie gdyby mimo przedłużającego się ogrzewania nie dochodziło do stopniowego zmętnienia roztworu, to reakcję można aktywować poprzez dodatek kilku niewielkich kryształków jodu I2.
Jeśli synteza się powiodła, to w jej wyniku otrzymaliśmy związek Grignarda. Zawartość kolby powinna wyglądać mniej więcej jak na Fot.6.
Po przeprowadzeniu syntezy aparaturę należy rozmontować, a kolbę z produktem (i pozostałościami metalicznego magnezu) szczelnie zamknąć – ma to na celu ograniczenie dostępu pary wodnej i tlenu z powietrza. Nawet w takich warunkach produkt nie jest zbyt trwały, więc dalsze obserwacje najlepiej przeprowadzić bezpośrednio po syntezie.
Chemiluminescencja – nagroda za trudy
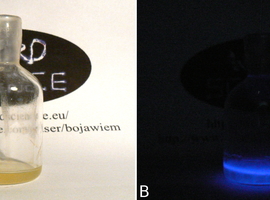
Otrzymany związek Gringarda jest tak reaktywny, że aby obserwować jego chemiluminescencję nie są potrzebne żadne specjalne substancje chemiczne – wystarczy tutaj tlen atmosferyczny.
Kilka centymetrów sześciennych otrzymanego roztworu trzeba przenieść do otwartego naczynia za pomocą np. pipety Pasteura (Fot.7A). Nie należy go przelewać.
Po umożliwieniu dostępu powietrza do cieczy daje się zauważyć wyraźna niebieska poświata. Trwa ona tak długo, jak cały zapas związku magnezoorganicznego nie zostanie utleniony (Fot.7B).
Zauważmy, że najbardziej intensywnie roztwór świeci przy swojej powierzchni, czyli w miejscu kontaktu z powietrzem zawierającym tlen.
Pokaz chemiluminescencji opisywanej substancji można też przeprowadzić inaczej: upuszczać z pipety Pasteura krople roztworu na szalkę Petriego. Przy każdym rozprysku pojawia się wtedy łatwy do zauważenia w ciemności rozbłysk światła.
Intensywność reakcji możemy zwiększyć poprzez mieszanie lub przedmuchiwanie powietrza nad powierzchnią cieczy. Obie metody umożliwiają zwiększenie jasności uzyskiwanego światła, ale jednocześnie skracają czas jego emisji. W każdym razie uzyskiwany w ten sposób efekt jest naprawdę widowiskowy (Fot.8).
Myślę, że opisana metoda otrzymywania związku magnezoorganicznego i jego reakcja chemiluminescencyjna mają duży walor dydaktyczny, ponieważ w ciekawy sposób zaznajamiają zarówno z problematyką syntezy organicznej, jak i efektami energetycznymi procesów chemicznych.
Wyjaśnienie
Przedstawioną syntezę związku Gringarda z 1,4-dibromobenzenu (przedstawionego tutaj jako Br-C6H4-Br) i metalicznego magnezu można opisać następującym równaniem reakcji:
Uzyskany związek Gringarda Br-Mg-C6H4-Br reaguje z tlenem:
Reakcji tej towarzyszy uwolnienie kwantów promieniowania elektromagnetycznego o energii hν odpowiadającej światłu niebieskiemu. Tak więc to właśnie ta przemiana chemiczna daje efekt chemiluminescencji.
Następnie zachodzi reakcja:
Jak widać, powstały produkt reaguje dalej z wodą [8]. Może się ona dostać do środowiska reakcji np. z powietrzem.
Wiele związków Grignarda wykazuje chemiluminescencję nie tylko podczas utleniania, ale także w reakcji z chloropikryną CCl3NO2. Tego typu procesy nazywa się często reakcjami Wedekinda [9].
Reakcje chemiluminescencji przebiegają zgodnie z pewnym schematem:
W wyniku reakcji substratu (a raczej substratów) X powstaje produkt przejściowy [Y]* występujący w stanie wzbudzonym o wysokiej energii. Jest to jednak sytuacja nietrwała i przekształca się on do produktu ostatecznego Y istniejącego w stanie podstawowym, o niższej energii. Zgodnie z zasadą zachowania różnica energii między stanem wzbudzonym a podstawowym zostaje oddana do środowiska. W przypadku chemiluminescencji proces ten zachodzi na drodze emisji promieniowania elektromagnetycznego [10].
Reakcje chemiluminescencji są reakcjami egzoenergetycznymi, czyli w czasie ich zachodzenia energia wiązań chemicznych zostaje przetworzona w inne formy i oddana do środowiska. Są one z tego powodu bardzo ciekawe, ponieważ wraz z reakcjami egzotermicznymi (gdzie energia jest oddawana do otoczenia pod postacią ciepła) i innymi pozwalają na zapoznanie się z procesami przemian energii i materii.
Przedstawiona synteza może być traktowana jako wstęp do innych ciekawych syntez i reakcji, także chemiluminescencyjnych. Przykładem tu może być wielobarwna (zależna od wykorzystanego sensybilizatora) emisja światła w czasie utleniania pewnych pochodnych kwasu szczawiowego (Fot.9).
Literatura:
- [1] Hassa R., Mrzigod J., Podręczny słownik chemiczny (wyd. I), Videograf II, Katowice, 2004, str. 153 powrót
- [2] Ples M., Widmowy blask - chemiluminescencja katalizowana związkiem miedzi, Chemia w Szkole, 2 (2016), Agencja AS Józef Szewczyk, str. 13-17 powrót
- [3] Ples M., Światło z retorty, Chemia w Szkole, 5 (2014), Agencja AS Józef Szewczyk, str. 33-34 powrót
- [4] Ples M., Całkiem niezwykła herbatka, Chemia w Szkole, 4 (2015), Agencja AS Józef Szewczyk, str. 6-9 powrót
- [5] Ples M., Co i jak można otrzymać z piasku? Nieznane oblicze krzemu, Chemia w Szkole, 6 (2016), Agencja AS Józef Szewczyk, str. 38-43 powrót
- [6] Lide D.R., CRC Handbook of Chemistry and Physics, CRC Press, 2009, str. 15-16 powrót
- [7] Evans W.V., Dufford R.T., Luminescence Of Compounds Formed By The Action Of Magnesium On Para-Dibromobenzene And Related Compounds, Journal of the American Chemical Society, 45 (2), 1923, str. 278-285 powrót
- [8] Pluciński T., Doświadczenia Chemiczne, Adamantan, Warszawa, 1997, str. 27 powrót
- [9] Dufford R. T., Calvert S., Nightingale D., Luminescence Of Organo-Magnesium Halides, Journal Of The American Chemical Society, 45, 1923, str. 2058-2072 powrót
- [10] Rauhut M.M., Chemiluminescence, w: Grayson M., Kirk-Othmer Concise Encyclopedia of Chemical Technology, Wiley, 1985, str. 247 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples