Katalaza - tlen trucizną
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (1/2019):

Zbiór wszystkich reakcji chemicznych i związanych z nimi przemian energii zachodzących w organizmach żywych nazywamy metabolizmem. Procesy te pozwalają na uzyskiwanie przez organizm energii, utrzymanie uporządkowanej struktury, wzrost, rozmnażanie i odpowiadanie na bodźce pochodzące ze środowiska zewnętrznego.
Reakcje metaboliczne szereguje się zwykle do dwóch głównych klas: katabolicznych i anabolicznych. Pierwsze z nich przekształcają związki chemiczne z wytworzeniem możliwej do wykorzystania w ustroju energii, drugie zaś wymagają dostarczenia energii. Do katabolizmu zaliczają się więc reakcje egzoenergetyczne, a do anabolizmu endoenergetyczne [1] [2].
Stopień skomplikowania reakcji metabolicznych jest bardzo wysoki i są one zorganizowane w tzw. szlaki metaboliczne. Mianem tym określa się szeregi procesów, w których produkty jednej reakcji (metabolity) są wykorzystywane jako substraty kolejnej. Niektóre szlaki metaboliczne zazębiają się na określonych etapach z innymi. Wiele z wspomnianych reakcji jest niekorzystnych termodynamicznie. Dlatego bardzo istotną rolę pełnią tutaj enzymy, czyli biologiczne katalizatory [3]. Poza obniżaniem energii aktywacji reakcji metabolicznych enzymy pozwalają także na regulację wydajności działania określonych szlaków. Ich specyficzność jest z reguły dużo większa niż katalizatorów nieorganicznych, co ma wielkie znaczenie dla organizmu. Dzieje się tak, ponieważ każdy enzym katalizuje zaledwie kilka reakcji spośród wielu możliwych dla danych substratów. W ten sposób enzymy determinują procesy metaboliczne składające się na chemiczną stronę fenomenu nazywanego przez nas życiem.
Większość enzymów to wielkocząsteczkowe ciała białkowe, jednak istnieją też enzymy niebiałkowe, np. rybozymy zbudowane z kwasu rybonukleinowego.
Wśród wielkiej liczby istniejących enzymów wybrałem dziś jeden, z którym przeprowadzimy kilka ciekawych doświadczeń. Jest to katalaza, otrzymana w stanie krystalicznym po raz pierwszy w 1937 roku przez J.B. Sumnera [4]. Należy ona do klasy oksydoreduktaz, czyli biologicznych katalizatorów procesów redoks.
Doświadczenie
Źródłem katalazy do naszych doświadczeń może być zróżnicowany materiał biologiczny. Możemy wykorzystać katalazę występującą w komórkach bulwy pędowej ziemniaka Solanum tuberosum (Fot.1).
By otrzymać preparat zawierający katalazę należy obrać surową bulwę ziemniaka, pociąć ją na fragmenty odpowiedniej wielkości, a następnie utrzeć (najlepiej używając kuchennego blendera) wraz z niewielką ilością wody o temperaturze pokojowej. Przecier należy następnie przesączyć przez gazę. Uzyskany płyn najlepiej szybko wykorzystać, ponieważ nie można go zbyt długo przechowywać (Fot.2). Pamiętajmy też, że wyciąg obok interesującej nas katalazy może zawierać też inne substancję, m.in. toksyczną dla człowieka solaninę C45H73NO15 należącą do glikoalkaloidów.
Chcąc przekonać się o charakterystycznych właściwościach omawianego przez nas enzymu musimy zbudować prostą aparaturę, której schemat przedstawia Rys.1.
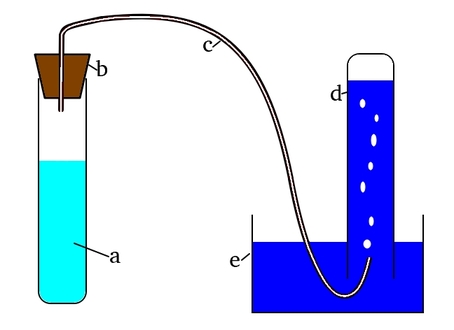
Układ składa się z naczynia a zawierającego roztwór nadtlenku wodoru H2O2 o stężeniu 3% (apteczną wodę utlenioną) i katalazę, zamkniętego korkiem b, w którym jest osadzona elastyczna rurka c. Drugi koniec rurki uchodzi do odwróconej do góry dnem probówki d zanurzonej w naczyniu e. Probówka jest początkowo całkowicie wypełniona wodą, która będzie wypierana przez powstający w reakcji gaz.
W razie zastosowania elastycznej rurki pewnym problemem może być jej trwałe wygięcie w kształt ułatwiający umieszczenie końca w probówce. Chciałbym zaproponować prosty sposób rozwiązania tej kwestii. W tym celu należy przygotować fragment dosyć sztywnego drutu – np. miedzianego o średnicy 1,5-2mm, jak to widać na Fot.3.
Drut po wsunięciu do rurki nie blokuje jej światła, a jednocześnie pozwala na odpowiednie wygięcie i ukształtowanie rurki w zależności od potrzeb (Fot.4).
Naczynie reakcyjne (Rys.1a) dosyć wygodnie jest zastąpić strzykawką, np. o pojemności 10cm3. Zbudowany w ten sposób zestaw doświadczalny przedstawia Fot.5.
W strzykawce umieszczono około 4cm3 wody utlenionej, a następnie dodano 2cm3 świeżo przygotowanego ekstraktu ziemniaczanego. Prawie natychmiast możemy zaobserwować efekt rozpoczęcia się reakcji: gwałtowne pienienie się mieszaniny i uwalniane dużych ilości jakiegoś gazu (Fot.6).
Uchodzący przez rurkę gaz jest kierowany do probówki i zbiera się nad powierzchnią wody, stopniowo wypierając ją z naczynia (Fot.7).
Jak widzimy, w reakcji powstaje pewien gaz. Nie ma on barwy ani zapachu. Dosyć łatwo go zidentyfikować wkładając żarzące się drewienko do probówki. Można zrobić to też inaczej: do żarzącego się drewienka (Fot.8A) zbliżyć ujście rurki, którą płynie powstający gaz. W obu przypadkach w kontakcie z badanym gazem drewienko gwałtownie rozpala się jasnym płomieniem (Fot.8B).
Uzyskany efekt próby wskazuje, że powstającym gazem jest tlen O2, który podtrzymuje spalanie. W atmosferze wzbogaconej w tlen (w stosunku do powietrza atmosferycznego) lub w czystym tlenie spalanie zachodzi o wiele energiczniej.
W kolejnych doświadczeniach zastosujemy inny materiał. Bogatym źródłem katalazy są drożdże Saccharomyces cerevisiae np. piekarnicze prasowane (Fot.9).
Drożdże będące jednokomórkowymi grzybami są jednymi z najczęściej wykorzystywanych przez człowieka mikroorganizmów.
Do naszych celów odrobinę drożdży trzeba rozprowadzić w niewielkiej ilości letniej wody. Otrzymujemy w ten sposób zawiesinę komórek drożdżowych (Fot.10).
Do trzech probówek wprowadźmy kilka cm3 wody utlenionej z dodatkiem detergentu np. płynu do mycia naczyń (Fot.11A). Probówka a stanowi próbę kontrolną i do niej dodajemy jedynie 1cm3 wody, do próbówki b taką samą objętość zawiesiny drożdży, natomiast do probówki c zawiesinę, która została na krótko doprowadzona do temperatury wrzenia, a następnie ostudzona do temperatury pokojowej.
Już po kilku sekundach można zauważyć wyraźne zmiany w wyglądzie próbek (Fot.11B). W probówce b z zawiesiną drożdży zaczyna powstawać piana. Najwyraźniej ich komórki są bogate w katalazę. Efektu tego nie można stwierdzić w probówce c zawierającej drożdże potraktowane podwyższoną temperaturą.
Na marginesie: widoczny na fotografii stojak na probówki został wykonany z fragmentów strzykawek przyklejonych do plastikowej podstawy. Taka konstrukcja zapewnia większą przejrzystość ze wszystkich stron niż ma to miejsce w przypadku tradycyjnego statywu, a jednocześnie jest mało kosztowna i prosta do wykonania w warunkach szkolnych.
Wracając do tematu chciałbym zauważyć, że wyjaśnienie obserwowanego efektu jest dosyć proste. Powstający w reakcji tlen zostaje dzięki detergentowi uwięziony w obrębie cieczy, więc powstaje piana. Już po chwili – nawet z małych ilości reagentów – uzyskujemy całkiem dużą ilość dosyć sztywnej piany (Fot.12).
Fakt, że w próbie kontrolnej a nie zaszła żadna reakcja jest zrozumiały. Dlaczego jednak w próbce c , która zawierała przecież drożdże (tyle, że potraktowane odpowiednią temperaturą) nie możemy zauważyć podobnego efektu jak w przypadku b?
Wyjaśnienie
Omawiany enzym katalizuje reakcję rozkładu nadtlenku wodoru do wody i tlenu według równania reakcji:
Nadtlenek wodoru jest substancją niestabilną i samorzutnie ulega reakcji rozkładu do wody i gazowego tlenu. W normalnych warunkach, szczególnie w rozcieńczonych roztworach, reakcja zachodzi jednak stosunkowo powoli. Dodatek katalazy bardzo silnie przyspiesza ten proces, co zaobserwowaliśmy w opisanych doświadczeniach.
Nie zawsze zdajemy sobie sprawę z faktu, że życie w atmosferze tlenu jest dla organizmów żywych dosyć dużym wyzwaniem. Co prawda oddychanie tlenowe zapewnia możliwość wytworzenia większej ilości energii niż beztlenowe, ale jednocześnie powoduje powstanie tak zwanych reaktywnych form tlenu (ang. reactive oxygen species, ROS), których działanie jest destrukcyjne dla wielu elementów komórek. Do grupy tych niebezpiecznych substancji należy właśnie nadtlenek wodoru. Powstaje on jako produkt uboczny licznych procesów metabolicznych i aby chronić organizm przed utlenianiem nadtlenek musi zostać szybko przekształcony do innych substancji. Tlen cząsteczkowy jest dużo mniej reaktywny niż nadtlenki, więc działanie katalazy chroni komórkę przed uszkodzeniem [5].
Z uwagi na przytoczone fakty można więc stwierdzić, że tlen – a przynajmniej pewne jego formy - jest toksyczny. Organizmy wykorzystujące ten pierwiastek w procesie oddychania musiały więc wypracować odpowiednie mechanizmy obronne przeciwko niemu. Nie dziwi fakt, że katalazę można znaleźć u praktycznie wszystkich stworzeń żyjących w środowisku bogatym w tlen. Enzym ten jest także jednym z najbardziej wydajnych, ponieważ jest zdolny do przeprowadzenia milionów reakcji rozkładu cząsteczek nadtlenku wodoru w każdej sekundzie [6].
Struktura cząsteczki katalazy jest tetrameryczna - składa się z czterech łańcuchów polipeptydowych o długości ponad 500 aminokwasów. Jako ciało białkowe jest podatna na denaturację, więc działanie odpowiednio wysokiej temperatury nieodwracalnie niszczy jej strukturę i uniemożliwia działanie enzymu (vide probówka c w drugim doświadczeniu).
Działanie katalazy upośledza także obecność odpowiednich jonów metali ciężkich. Jeśli chodzi o pH, to optimum działania ludzkiej katalazy jest zbliżone do odczynu neutralnego. Sprawdzenie wpływu zróżnicowanych czynników na aktywność katalityczną enzymu może być przedmiotem dalszych nieskomplikowanych, ale ciekawych doświadczeń.
Literatura:
- [1] Berg J. M., Tymoczko J. L., Stryer L., Biochemia, Wydawnictwo Naukowe PWN, Warszawa, 2007 powrót
- [2] Mayes P. A., Bioenergetyka: rola ATP, w: Murray R. K., Kokot F., Koj A., Aleksandrowicz Z., Biochemia Harpera, Wydawnictwo Lekarskie PZWL, Warszawa, 2006, str. 159-166 powrót
- [3] Ples M., Enzymy - biologiczne katalizatory, Chemia w Szkole, 3 (2016), Agencja AS Józef Szewczyk, str. 6-11 powrót
- [4] Sumner J. B., Dounce A. L., Crystalline Catalase, Science, 85 (2206), 1937, str. 366-367 powrót
- [5] Gaetani G. F., Ferraris A. M., Rolfo M., Mangerini R., Arena S., Kirkman H. N., Predominant role of catalase in the disposal of hydrogen peroxide within human erythrocytes, Blood, 87 (4), 1996, str. 1595-1599 powrót
- [6] Goodsell D. S., Catalase, w serwisie: http://pdb101.rcsb.org, dostępne online: http://pdb101.rcsb.org/motm/57 [dostęp: 28.11.2018] powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples