Enzym spod ziemi - peroksydaza
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (2/2019):

Enzymy dawniej nazywane fermentami stanowią jedną z podstaw tego fascynującego – i dosyć ważnego nie tylko dla biologa – zbioru zjawisk fizykochemicznych tworzących materialną stronę fenomenu nazywanego przez nas życiem. Ich rola jest nieoceniona, ponieważ bez udziału tych substancji właściwie niemożliwe byłoby prowadzenie przez organizm reakcji metabolicznych, a więc przemiany materii i energii.
Działem biochemii zajmującym się enzymami jest oczywiście enzymologia. Bada ona strukturę tych substancji, ich właściwości, mechanizmy działania, funkcje, biosyntezę oraz sposoby ekstrakcji i oczyszczania. Ma to duże znaczenie choćby z punktu widzenia medycyny, ponieważ zaburzenia w pracy enzymów są często powodem chorób.
Swoistość katalitycznego działania enzymów jest bardzo zróżnicowana. Jedne z nich reagują tylko z określonym związkiem (oksydaza glukozowa utlenia praktycznie tylko D-glukozę), natomiast działanie innych jest możliwe np. w całej grupie podobnych substancji chemicznych. Do tej drugiej grupy należą peroksydazy, których działanie postaramy się zbadać praktycznie.
Materiał
Najlepszym źródłem peroksydazy do doświadczeń będzie korzeń chrzanu pospolitego Armoracia rusticana z rodziny kapustowatych Brassicaceae (Fot.1A). W razie jego braku można wykorzystać też korzeń pietruszki zwyczajnej Petroselinum crispum należącej do selerowatych Apiaceae (Fot.1B).
Obie rośliny są wykorzystywane w sztuce kulinarnej, a więc z ich zdobyciem nie będzie problemu. Nabycie korzenia chrzanu w miesiącach zimowych jest nieco trudniejsze, możemy się wtedy jednak posiłkować wykorzystaniem pietruszki obecnej w handlu przez cały rok (trzeba się wtedy jednak liczyć z nieco słabszym wynikiem prób).
Do wszystkich doświadczeń używać należy – o ile nie zaznaczono inaczej – surowych, nie poddanych obróbce termicznej tkanek korzeni.
Ku przestrodze
Pamiętając jaką przyjemność daje samodzielne eksperymentowanie nie możemy zapominać o możliwych zagrożeniach – szczególnie, że tym razem będziemy stosować wiele substancji, które z tego czy innego powodu mogą być niebezpieczne. Benzydyna i jej pochodne (także o-tolidyna) jest silnie toksyczna i rakotwórcza, o podobne właściwości podejrzewa się także luminol i fenoloftaleinę. Roztwory wodorotlenku sodu, nadtlenku wodoru i kwasu octowego o odpowiednio dużym stężeniu są żrące i mogą powodować trwałe uszkodzenia ciała w razie bezpośredniego kontaktu. Ten ostatni posiada także przykry duszący zapach i wykazuje trujące działanie przy ekspozycji na inhalację. W przypadku silnie rozdrobnionego metalicznego cynku zagrożenie jest odmiennej natury, ponieważ może on być łatwopalny - w kontakcie z pewnymi utleniaczami (np. z azotanem(V) amonu) substancja ta ulega wręcz samozapłonowi.
Osobną sprawą jest bezpieczeństwo przy podgrzewaniu nawet niewielkich ilości substancji, szczególnie żrących – trzeba to robić ostrożnie i delikatnie, nigdy nie kierując np. ujścia probówki ku ludziom lub zwierzętom.
Polecam zapoznanie się z właściwościami i niebezpieczeństwami związanymi z wykorzystywaniem tych substancji – pomocna może być lektura ich kart charakterystyk MSDS.
Z przedstawionych wyżej powodów konieczne jest, aby przygotowania, same doświadczenia, a także porządki po nich prowadzić w sposób odpowiedzialny i uważny. Nie ma tu miejsca na improwizację. Konieczne są środki ochrony osobistej: fartuch, rękawiczki i okulary ochronne, a w czasie ogrzewania żrących substancji najlepiej także ochrona twarzy.
Doświadczenie I
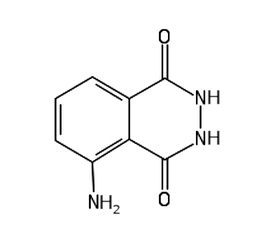
Aby wykryć obecność enzymu w tkankach korzeni wspomnianych roślin (lub innych) wykorzystamy specyficzną substancję chemiczną – luminol C8H7N3O2. Jest to organiczny związek chemiczny, hydrazyd kwasu 3-aminoftalowego o wzorze strukturalnym przedstawionym na Rys.1.
Luminol w warunkach normalnych posiada postać drobnokrystalicznego proszku o barwie od żółtawej do jasnobrązowej (Fot.2).
Musimy przygotować odpowiedni roztwór, poprzez rozpuszczenie w 50cm3 wody destylowanej 1g wodorotlenku sodu NaOH i niewielkiej ilości (rzędu miligramów) luminolu. Roztwór ten nie jest zbyt trwały, więc najlepiej sporządzać go na bieżąco. Do powstałego klarownego płynu dodajemy bezpośrednio przed wykonaniem próby 1,5cm3 nadtlenku wodoru H2O2 o stężeniu 30% (perhydrolu) lub odpowiednio większą ilość aptecznej wody utlenionej 3% uzyskując roztwór roboczy [1].
Korzeń chrzanu lub pietruszki po umyciu i osuszeniu należy utrzeć. Wystarczy niewielka ilość materiału (Fot.3).
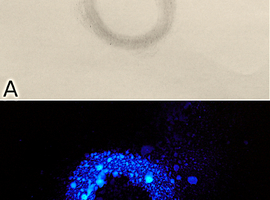
Materiał roślinny trzeba przenieść do roztworu (Fot.4). Można zaobserwować wtedy powstawanie pewnych ilości tlenu z rozkładu nadtlenku w kontakcie z substancjami wchodzącymi w skład tkanek roślinnych.
By móc poczynić najważniejszą obserwację musimy zaciemnić pomieszczenie. Możemy wtedy zobaczyć, że roztwór w zetknięciu z utartym korzeniem zaczyna bardzo wyraźnie… świecić. Wystarczy zamieszać płyn, by cała zawartość naczynia rozbłysnęła łatwym do zaobserwowania niebieskim światłem (Fot.5). Emisja jasnego światła może trwać od kilku do kilkunastu sekund, zaś słabszego nawet dłużej.
Istnieje też inny wariant opisanego doświadczenia: przeciętym korzeniem (lub wodnym wyciągiem z jego tkanek) możemy narysować jakiś wzór na papierze (Fot.6A). Po spryskaniu opisanym uprzednio roztworem roboczym możemy podziwiać wtedy świecące wzory na papierze (Fot.6B). Efekt doświadczenia zależy oczywiście od tego, jak dużo peroksydazy udało nam się nanieść na papier.
Przedstawione doświadczenie jest bardzo widowiskowe i nadaje się do prezentacji także przed stosunkowo licznym audytorium. Jak już wspomniano, potrzebna jest jednak możliwość zaciemnienia pomieszczenia.
Doświadczenie II
W tym doświadczeniu wykorzystamy dosyć powszechnie stosowaną w pracowni chemicznej i biologicznej fenoloftaleinę C20H14O4 (Rys.2).
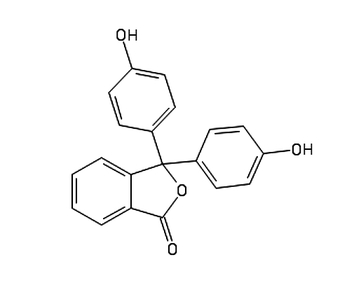
Fenoloftaleina to biały lub lekko żółtawy proszek (Fot.7), słabo rozpuszczalny w wodzie, za to dużo lepiej w alkoholach.
Wiemy, że fenoloftaleinę wykorzystuje się jako wskaźnik kwasowo-zasadowy, ponieważ w środowisku kwasowym i obojętnym nie wykazuje zabarwienia, natomiast w roztworach zasadowych staje się malinowa lub w dużym stężeniu fioletowa (Fot.8).
Przygotowując doświadczenie musimy sporządzić odpowiedni roztwór rozprowadzając 0,1g fenoloftaleiny w 10cm3 roztworu wodorotlenku sodu o stężeniu 25% [2].
Kolejną potrzebną nam substancją będzie sproszkowany cynk Zn w postaci ciemnoszarego, sypkiego proszku.
Do probówki osadzonej w odpowiedniej łapie wprowadzamy nieco proszku cynkowego (Fot.9A). Następnie do probówki należy przenieść przygotowany uprzednio roztwór fenoloftaleiny, wymieszać go z cynkiem i rozpocząć delikatne ogrzewanie na maszynce elektrycznej lub palnikiem spirytusowym (Fot.9B). Fioletowa ciecz powinna delikatnie wrzeć. Wszystkie czynności należy teraz wykonywać bardzo ostrożnie, ponieważ mamy przecież do czynienia z wrzącą i bardzo silnie żrącą cieczą. Po pewnym czasie płyn ulegnie całkowitemu odbarwieniu – przerywamy wtedy ogrzewanie i pozwalamy opaść osadowi składającemu się z pozostałego cynku i produktów reakcji (Fot.9C).
Ostudzony odbarwiony roztwór podstawowy można przechowywać dłuższy czas w szczelnie zamykanym naczyniu z brązowego szkła z odrobiną świeżego proszku cynkowego na dnie. Roztwór roboczy przygotowuje się mieszając jedną objętość roztworu podstawowego (pobierając go znad osadu cynku) z 9 objętościami alkoholu etylowego o stężeniu 70%. Odczynnik ten jest on nietrwały i musi być przygotowywany bezpośrednio przed doświadczeniem.
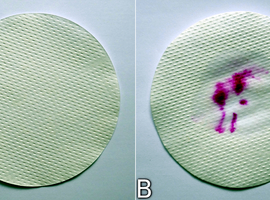
Chcąc wykryć obecność peroksydaz w korzeniu należy nanieść nieco wyciągu roślinnego na czystą (warunek konieczny, ponieważ niektóre zanieczyszczenia mogą fałszować wynik) bibułę filtracyjną, np. sączek. Często wystarczy też po prostu dociśnięcie obranego korzenia do bibuły. Po wyschnięciu na papierze praktycznie nie można zaobserwować śladu jakichkolwiek substancji (Fot.10A).
Jeśli jednak sączek zaimpregnowany peroksydazą zwilżymy roztworem roboczym, a następnie wodą utlenioną, to możemy zaobserwować stosunkowo szybkie pojawienie się barwy charakterystycznej dla fenoloftaleiny w środowisku zasadowym (Fot.10B).
W moim doświadczeniu wykorzystałem świeżo wykopany korzeń chrzanu – w innych przypadkach wynik może być bardziej subtelny niż na prezentowanej fotografii, a w szczególnych okolicznościach nawet trudny do zauważenia (np. jeśli korzeń był przechowywany zbyt długo lub w nieodpowiedniej temperaturze). Podobnie będzie w wypadku, gdy nawet świeży korzeń z jakichś powodów zawiera mniej enzymu. W takich przypadkach można spróbować bezpośrednio zwilżyć roztworami tkanki korzenia utarte z odrobiną wody i sprawdzić czy zaobserwujemy opisane wcześniej zabarwienie.
Pojawienie się barwy po dłuższym czasie lub jej całkowity brak interpretuje się jako negatywny wynik próby. W niektórych przypadkach mimo obecności peroksydazy wynik nie potwierdza tego faktu z różnych powodów – jednym z nich może być obecność substancji zaburzających przebieg reakcji.
Doświadczenie III
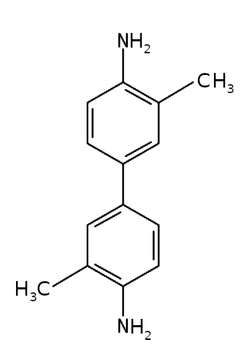
Substancją, którą wykorzystamy tym razem będzie benzydyna lub niektóre jej pochodne, np. sole. Należy rozpuścić 0,5-1g tej substancji w 20cm3 podgrzanego stężonego kwasu octowego CH3COOH, a następnie rozcieńczyć wodą destylowaną do objętości 50cm3 oraz dodać 1cm3 perhydrolu [3]. Ja w swoich doświadczeniach zamiast benzydyny wykorzystałem o-tolidynę C14H16N2 (Rys.3) [4].
Z korzenia pietruszki wykrojono następnie dwa plastry grubości około 5mm (Fot.11). Jeden z nich pozostawiono w stanie surowym, natomiast drugi sparzono poprzez zanurzenie we wrzącej wodzie na czas około jednej minuty, po czym ochłodzono do temperatury pokojowej.
Oba plastry należy następnie zanurzyć w roztworze (Fot.12). Można też zwilżyć nim materiał roślinny umieszczony na szalce Petriego.
Po chwili można zaobserwować pierwsze oznaki zachodzenia reakcji chemicznej: jeden z plastrów zaczyna się zabarwiać. Niedługo potem możemy wyjąć plastry z roztworu, bardzo dokładnie je wypłukać w bieżącej wodzie i porównać. Różnice są uderzające: plaster niepoddany obróbce cieplnej przyjął ciemnoniebieską, wręcz granatową barwę, podczas gdy sparzony nie wykazuje żadnych zmian, a wręcz mógł ulec pewnemu odbarwieniu (Fot.13).
Tak więc obserwacje ujawniają, że w wyniku potraktowania przygotowanym odczynnikiem tkanki roślin zawierające peroksydazę ulegają wybarwieniu, ale tylko, jeśli nie zostały one potraktowane podwyższoną temperaturą.
Wyjaśnienie
Peroksydazy to dosyć liczna grupa enzymów należących do klasy oksydoreduktaz. Katalizują one utlenianie nadtlenkiem wodoru wielu różnych substratów. Można to przedstawić w postaci równania reakcji (XH2 – substrat w formie zredukowanej, X - produkt utleniania):
Rolę kofaktora pełni w opisywanym enzymie hem posiadający w swojej strukturze układ porfirynowy z atomem żelaza Fe w centrum. Chociaż najczęściej wykorzystywanym przez peroksydazy substratem jest nadtlenek wodoru, to niektóre z nich mogą także wykorzystywać inne, np. nadtlenki organiczne.
Enzymy z tej grupy można podzielić na trzy klasy:
- I - do której są zaliczane peroksydazy bakteryjne i peroksydaza askorbinowa,
- II - peroksydazy grzybowe,
- III - peroksydazy występujące w tkankach roślin wyższych [5].
W dzisiejszych doświadczeniach przekonaliśmy się o działaniu peroksydaz z III klasy. Peroksydaza chrzanowa (ang. horseradish peroxidase, HRP) jest powszechnie stosowana w różnorodnych celach komercyjnych.
Enzymy o podobnym działaniu występują także u zwierząt. Przykładem może być peroksydaza glutationowa.
Luminol wykorzystany w pierwszym doświadczeniu należy do klasy substancji chemicznych wykazujących zdolność do chemiluminescencji, tj. emisji światła w czasie przemian chemicznych. W tym konkretnym przypadku podczas utleniania luminolu nadtlenkiem wodoru powstaje produkt istniejący początkowo w tzw. stanie wzbudzonym o wysokiej energii. Jest to jednak sytuacja nietrwała, a stan wzbudzony zostaje szybko zredukowany do podstawowego o niższej energii. Zgodnie z zasadą zachowania różnica energii zostaje wtedy oddana do środowiska – w tym przypadku na sposób światła o niebieskiej barwie. Co ważne, w środowisku wodnym reakcja ta przebiega bardzo powoli, a emisja promieniowania jest praktycznie niezauważalna. Reakcję przyspiesza wiele katalizatorów, zarówno nieorganicznych np. heksacyjanożelazian(III) potasu K3[Fe(CN)6], jak i organicznych, np. zawierających w swojej strukturze hem. Nie dziwi więc fakt, że peroksydaza jest zdolna do utleniania luminolu nadtlenkiem wodoru, czego efekt zaobserwowaliśmy w doświadczeniu.
Nieco inaczej sprawa wygląda w przypadku drugiego doświadczenia. Użyta przez nas fioletowa (w środowisku alkalicznym) fenoloftaleina, podczas ogrzewania w odpowiednim roztworze z dodatkiem metalicznego cynku ulega redukcji do bezbarwnej fenoloftaliny, nazywanej też leukofenoloftaleiną – obserwujemy więc odbarwienie. Fenoloftalina jest jednak podatna na utlenianie (dlatego przechowujemy jej roztwór w ciągłym kontakcie z redukującym cynkiem). Jeśli więc w próbce jest obecny jakiś katalizator utleniania nadtlenkiem wodoru, to bezbarwny związek zostanie na powrót przekształcony w fioletową w tych warunkach fenoloftaleinę, co zaobserwowaliśmy.
Opisaną reakcję z fenoloftaliną – podobnie jak poprzednią z luminolem – stosuje się dosyć powszechnie do wykrywania krwi, czy raczej zawartej w erytrocytach hemoglobiny, ponieważ występujący w jej strukturze hem także katalizuje przedstawione reakcje. Jest to wykorzystywane np. w kryminalistyce, a przygotowany w przedstawiony w artykule sposób roztwór fenoloftaliny nosi nazwę odczynnika Kastle–Meyera.
Warto zaznaczyć, że według niektórych badaczy sama peroksydaza może nie ujawniać swojej obecności podczas testu z fenoloftaliną [6]. W takim przypadku za obserwowany efekt musiałby być odpowiedzialny inny – zapewne także angażujący ten enzym, ale bardziej skomplikowany – mechanizm utleniania.
Także w trzecim doświadczeniu powodem obserwowanej zmiany było utlenianie – tym razem pochodnej benzydyny do barwnego produktu, tutaj niebieskiego. Stało się tak jedynie w przypadku tkanki, wobec której nie zastosowano obróbki cieplnej. Peroksydaza jako holoenzym jest zbudowana z części białkowej (apoenzymu) i niebiałkowej (hemu jako kofaktora). Struktura przestrzenna jest kluczowa dla rozwinięcia aktywności enzymatycznej, a wysoka temperatura powoduje zmiany w II, III- i IV-rzędowej strukturze elementu białkowego. Prowadzi to oczywiście do utraty aktywności biologicznej. Z tego powodu próbka ogrzana do temperatury wrzenia wody nie wykazywała aktywności peroksydazy.
Funkcje peroksydaz w organizmach są bardzo różnorodne i nie w sposób tu wymienić wszystkich. Wspomnę jednak, że wydają się one pełnić rolę m.in w mechanizmach obronnych, jakie rośliny stosują przeciwko patogenom. U wielu przedstawicieli rodziny psiankowatych Solanaceae, np. u psianki podłużnej (Solanum melongena, czyli bałażana lub oberżyny) zaobserwowano, że ekspresja genów odpowiedzialnych za syntezę peroksydazy gwajakolowej rozpoczyna się w ciągu zaledwie niewielu minut od wniknięcia bakterii do organizmu [7].
Nieco podobnym w działaniu do peroksydazy jest opisywana w poprzednim numerze Biologii w Szkole katalaza. Nie katalizuje ona jednak reakcji utleniania kosztem nadtlenku wodoru, a jedynie jego rozkład [8].
Literatura:
- [1] Ples M., Chemik na tropie - chemiluminescencja aktywowana krwią, w serwisie: https://weirdscience.eu, dostępne online: http://weirdscience.eu/Chemik%20na%20tropie%20-%20chemiluminescencja%20aktywowana%20krwi%C4%85.html [dostęp: 25.01.2019] powrót
- [2] Ples M., Śledztwo – prosta metoda wykrywania obecności krwi, Chemia w Szkole, 5 (2018), Agencja AS Józef Szewczyk, str. 6-10 powrót
- [3] Pluciński T., Doświadczenia Chemiczne, Wydawnictwo Adamantan, 1997, str. 92-93 powrót
- [4] Pluciński T., Peroksydaza, w serwisie: http://www.tomek.strony.ug.edu.pl/, dostępne online: http://www.tomek.strony.ug.edu.pl/peroksydaza.htm [dostęp: 25.01.2019] powrót
- [5] Welinder K. G., Superfamily of plant, fungal and bacterial peroxidases, Current Opinion in Structural Biology, 2 (3), 1992, str. 388-393 powrót
- [6] Ahmed S. A., Gowda H. S., Phenothiazines as reagents for the detection of faecal occult blood, Clinica Chimica Acta, 111(2-3), 1981, str. 275-278 powrót
- [7] Prakasha A., Umesha S., Biochemical and Molecular Variations of Guaiacol Peroxidase and Total Phenols in Bacterial Wilt Pathogenesis of Solanum melongena, Biochemistry & Analytical Biochemistry, 2016, 5(292) powrót
- [8] Ples M., Katalaza - tlen trucizną, Biologia w Szkole, 1 (2019), Forum Media Polska Sp. z o.o., str. 60-63 powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples