Widmowy blask
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (2/2016):

Chemiluminescencja katalizowana kompleksem miedzi
Zastanawiające, że chemia przez wielu jest traktowana jako swego rodzaju wiedza tajemna. A przecież czasy alchemików parających się poszukiwaniem kamienia filozoficznego należą do przeszłości. Dziś wiedza chemiczna jest dostępna dla każdego – potrzeba jedynie nieco chęci i wytrwałości w dążeniu do jej zdobycia.
Trzeba jednak przyznać, że chemicy mogą także dziś zadziwiać tworzeniem olśniewających efektów wizualnych, czasem wręcz przywodzących na myśl sztuki magiczne. Ważne jest jednak, by takie pokazy prowokowały także do stawiania pytań oraz zastanowienia się nad stojącymi za nimi zjawiskami i prawidłowościami. Następnym krokiem powinno być poszukiwanie odpowiedzi i jej uzyskanie. Bez tego nawet najpiękniejszy pokaz chemiczny jest bezprzedmiotowy.
Jednym z pozwalających na zapoznanie się z ciekawym zjawiskiem chemiluminescencji (jako przykładu przemian energii zachodzących w czasie reakcji chemicznych), a przy tym intrygujących doświadczeń jest spreparowanie świecącego w ciemności napisu lub innego wzoru. Proponowany w literaturze sposób, wymagający użycia kredy nasączonej roztworem silnie toksycznej białej odmiany alotropowej fosforu w trującym, lotnym i łatwopalnym dwusiarczku węgla nie wydaje się jednak godny polecenia, szczególnie w warunkach szkolnych [1]. Dlatego w niniejszym opracowaniu chciałbym przedstawić inny, znacznie bezpieczniejszy sposób na uzyskanie tego interesującego efektu.
Doświadczenie
Dla przeprowadzenia doświadczenia potrzebujemy substancji z poniższej listy:
- luminol C8H7N3O2
- wersenian disodu C10H14N2O8Na2
- woda amoniakalna 25% NH3(aq)
- nadtlenek wodoru 3% H2O2
Substancją pełniącą kluczową rolę w doświadczeniu jest luminol, czyli hydrazyd kwasu 3-aminoftalowego. Jego wzór strukturalny przedstawia Rys.1.
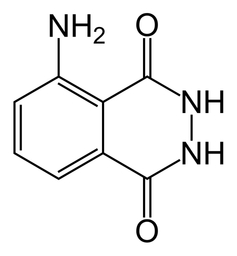
Luminol jest ciałem stałym o barwie żółtawej (Fot.1). W zależności od metody syntezy i ewentualnych zanieczyszczeń barwa może się jednak nieco różnić od widocznej na fotografii.
Luminol często wydaje się trudny do zdobycia, jednak jego pozyskanie w dzisiejszych czasach nie stanowi dużego problemu. Związek ten otrzymuje się zwykle w procesie kilkuetapowej syntezy, gdzie substancją wyjściową jest kwas ftalowy C8H6O4 lub jego bezwodnik C8H4O3. W szkolnym lub uczelnianym laboratorium można się pokusić o otrzymanie tego związku i wybrać najbardziej odpowiednią metodę syntezy [2] [3]. Wymaga to jednak ostrożności i doświadczenia w tego rodzaju pracach, w szczególności na etapie nitrowania kwasu ftalowego.
Wersenian disodu ma postać białej substancji krystalicznej i jest sodową solą kwasu etylenodiaminotetraoctowego, zwyczajowo nazywanego wersenowym lub edetynowym (ang. ethylenediaminetetraacetic acid, EDTA). Związek ten jest organicznym kwasem polikarboksylowym. Z racji występowania w jego strukturze grup aminowych można go też zaliczyć do rodziny aminokwasów. W doświadczeniu można właściwie użyć wolnego kwasu wersenowego, jednak jego sól jest znacznie lepiej rozpuszczalna w wodzie, przez co jej zastosowanie jest wygodniejsze.
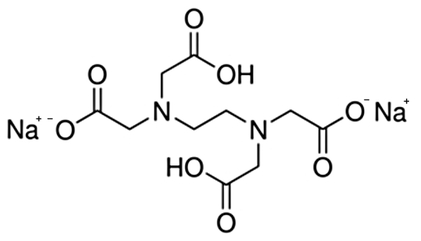
Obie przedstawione substancje mogą być szkodliwe i działają drażniąco w kontakcie ze skórą, oczami i drogami oddechowymi. Luminol podejrzewa się o działanie kancerogenne. Należy unikać jakiegokolwiek bezpośredniego kontaktu chemikaliów ze skórą i stosować środki ochrony osobistej. Woda amoniakalna, z powodu ulatniającego się gazowego amoniaku ma szczególnie nieprzyjemny, duszący zapach i działa drażniąco na oczy oraz drogi oddechowe. Amoniak w dużych stężeniach jest trujący! Zalecam, by wszelkie prace z tą substancją prowadzić pod sprawnym wyciągiem lub na zewnątrz.
Doświadczenie rozpoczynamy od przygotowania roztworu. Do 95 cm3 wody destylowanej dodajemy 5 cm3 25% wody amoniakalnej. W powstałym lekko alkalicznym roztworze rozpuszczamy następnie 0,01 g luminolu i 0,05 g wersenianu disodowego. Luminol dosyć powoli rozpuszcza się w wodzie – intensywne mieszanie roztworu przyspiesza ten proces. Po rozpuszczeniu substancji stałych dodajemy jeszcze 1 cm3 nadtlenku wodoru o stężeniu 3% (apteczna woda utleniona). Uzyskany bezbarwny lub lekko żółtawy roztwór (Fot.2) jest nietrwały i nie może być zbyt długo przechowywany. Najlepiej sporządzać go bezpośrednio przed doświadczeniem.
Musimy się jeszcze postarać o jakiś przedmiot wykonany z miedzi. Odpowiedni będzie zwykły nieizolowany drut miedziany – należy go oczyścić z warstwy tlenków i odtłuścić. Dla lepszego efektu drut można zwinąć w kształt np. helisy. Drut zanurzamy następnie w roztworze (Fot. 3A). W ciemności można wtedy zauważyć piękne zjawisko: powierzchnia metalu jarzy się widmowym, niebieskim blaskiem (Fot. 3B). Przy bliższej obserwacji przekonamy się, że tak naprawdę nie świeci powierzchnia metalu, lecz roztwór w jego bezpośrednim sąsiedztwie.
Spróbujmy sprawdzić, czy miedź zawarta w stopach będzie także powodowała świecenie roztworu. Możemy tu wykorzystać zwykłe monety o nominałach 1, 2 i 5 groszy. Do 2014 roku były one produkowane z odpowiedniej odmiany mosiądzu, będącego stopem składającym się głównie z miedzi i cynku. Po tym roku wspomniane monety zaczęto bić ze stali pokrytej mosiądzem [4]. Monety te można odróżnić od siebie oczywiście po umieszczonej na nich dacie produkcji, ale jest też inny sposób. Wystarczy użyć magnesu. Nowsze, jako wykonane w dużej mierze z żelaza będącego ferromagnetykiem są silnie przyciągane przez magnes, przeciwieństwie do starszych, nie zawierających w swym składzie żelaza. W każdym razie do doświadczenia nadają się wszelkie monety wykonane ze stopów zawierających w swym składzie odpowiednio dużo miedzi.
Efekt doświadczenia przedstawia Fot. 4. Została w nim wykorzystana moneta jednogroszowa wyprodukowana w 2015 roku (Fot. 4A). Podobnie jak w przypadku drutu miedzianego można zauważyć wyraźną chemiluminescencję. Moneta nie ulega uszkodzeniu w czasie doświadczenia jeśli nie pozostawiamy jej w roztworze zbyt długo. Po wyjęciu z roztworu trzeba ją jedynie dokładnie umyć i oczyścić z ewentualnego osadu.
Możliwości nie kończą się oczywiście na tym. Wykazując się odrobiną fantazji można tworzyć świecące symbole czy całe obrazy. Fot. 5 przedstawia prosty przykład: drut został wygięty w kształt zabawnej, uśmiechniętej twarzy. Zaznaczone fragmenty drutu pokryto bezbarwnym lakierem poliwinylobutyralowym – zamiast niego można z powodzeniem użyć lakieru do paznokci.
Podobnie jak poprzednio, po zalaniu miedzianej figury roztworem zaciemniamy pomieszczenie. Naszym oczom ukazuje się wtedy świecąca buzia, uśmiechająca się do nas ze zlewki (Fot.6). Miejsca osłonięte lakierem nie świecą, co utwierdza nas w przekonaniu, że aby doszło do emisji światła konieczny w tym przypadku jest bezpośredni kontakt użytego roztworu i miedzi. Jest to przydatne, ponieważ umożliwia uzyskanie efektu świecenia oczu i ust, podczas gdy podtrzymujące je elementy są w ciemności zupełnie niewidoczne.
Przyszła chwila, by pokusić się o wykonanie obiecanych na wstępie świecących napisów. Można oczywiście spróbować wygiąć litery i inne znaki z cienkiego drutu, ale nie jest to łatwe. Dlatego chciałbym zaproponować inny sposób. Wykonamy metaliczny napis w technice stosowanej w elektronice przy produkcji tak zwanych obwodów drukowanych (ang. printed circuit board, PCB). Obwód taki stanowi płytka z materiału izolacyjnego, na którą naniesiono ścieżki miedziane pełniące funkcję połączeń elektrycznych. Ścieżki wykonuje się metodą trawienia chemicznego. Zastosujemy metodę wykorzystywaną przy ręcznej produkcji niezbyt skomplikowanych obwodów drukowanych (np. prototypowych). Oczywiście w tym przypadku zamiast metalicznych ścieżek łączących elementy elektroniczne wytworzymy odpowiedni napis.
Pracę trzeba rozpocząć od przygotowania płytki. Odpowiednie w tym celu są płytki z laminatu pokrytego jednostronne miedzią, jakie można nabyć w sklepach z elementami elektronicznymi (Fot. 7A). Płytkę należy dobrze wyczyścić w ciepłej wodzie z dodatkiem detergentu, a następnie odtłuścić przez przemycie acetonem. Elementy napisu lub rysunku wykonujemy za pomocą pisaka (Fot. 7B). Musi to być jednak tak zwany marker permanentny, którego tusz jest nierozpuszczalny w wodzie. W razie jego braku napisy można wykonać za pomocą lakieru, np. do paznokci.
Kiedy tusz wyschnie, należy przygotować roztwór trawiący. Dobre wyniki osiąga się przy zastosowaniu nadsiarczanu sodu Na2S2O8, będącego białym ciałem krystalicznym. Trzeba pamiętać przy tym, że substancja ta jest szkodliwa, należy więc zachować odpowiednie środki ostrożności.
Potrzebny roztwór przygotowuje się przez rozpuszczenie nadsiarczanu w wodzie destylowanej o temperaturze około 50°C, a jego stężenie powinno wynosić około 20%. Trawienie prowadzi się zanurzając w roztworze o temperaturze do 40°C płytkę - napisem do góry - w naczyniu ceramicznym lub szklanym (Fot. 7C). Zachodzi wtedy reakcja:
Wolna miedź Cu ulega roztworzeniu i przechodzi do roztworu w postaci kationów Cu2+. Dzieje się tak tylko w miejscach nieosłoniętych tuszem, do których roztwór trawiący ma bezpośredni dostęp. Po pewnym czasie zauważymy, że poza napisem cała miedź uległa roztworzeniu – trwa to zwykle kilkanaście, kilkadziesiąt minut. Pomocne jest delikatne mieszanie roztworu. Płytkę trzeba wtedy opłukać dużą ilością wody, a tusz zmyć acetonem lub innym rozpuszczalnikiem organicznym. Gotową płytkę przedstawia Fot.7D.
Dalej postępujemy podobnie jak poprzednio, tzn. zanurzamy płytkę w roztworze luminolu (Fot. 8).
Wysiłek włożony w przygotowanie płytki opłacił się: w ciemności są widoczne pięknie świecące napisy (Fot. 9).
We wszystkich przedstawionych przypadkach wyraźnie widoczna chemiluminescencja trwa dosyć długo, nawet do około 30 minut w zależności od ilości użytego roztworu.
Wyjaśnienie
Chemiluminescencję definiuje się jako zjawisko emisji promieniowania elektromagnetycznego z zakresu światła widzialnego lub zbliżonego, będące efektem zachodzenia specyficznych reakcji chemicznych. Wiele substancji wykazuje zdolność do chemiluminescencji, między innymi występująca naturalnie lucyferyna robaczków świętojańskich Lampyris noctiluca [5], biała odmiana alotropowa fosforu, tlen w stanie singletowym, lofina, polifenole i inne. Stosunkowo wydajnym chemiluminoforem jest zastosowany w doświadczeniu luminol.
Postaram się przybliżyć Czytelnikowi mechanizm świecenia roztworu luminolu. W zasadowym roztworze luminol występuje w postaci dwuujemnego anionu. Ma tu miejsce zjawisko nazywane tautomerią keto-enolową lub enolizacją. Objawia się to tym, że wspomniany anion występuje w dwóch różnych formach nieróżniących się składem, a jedynie budową. W formie ketonowej ładunek ujemny jest zlokalizowany na atomach azotu, natomiast w enolowej - na atomach tlenu. Obie formy istnieją w stanie równowagi dynamicznej, w sposób ciągły przechodząc jedna w drugą (Rys. 3).
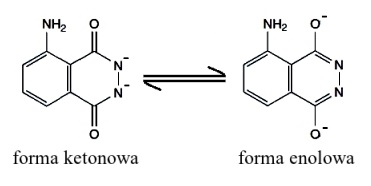
W dalszych etapach reakcji bierze udział forma enolowa (Rys. 4). W środowisku zasadowym luminol zostaje utleniony przez nadtlenek wodoru w obecności katalizatora do cyklicznego nadtlenku. Związek taki, m.in. z racji występowania w jego strukturze mostka nadtlenkowego, jest nietrwały i w warunkach reakcji ulega rozpadowi na cząsteczkę wolnego azotu N2 i 3-aminoftalan. Co ważne, ten ostatni początkowo istnieje w stanie wzbudzonym, o wysokiej energii. Sytuacja taka jest oczywiście niestabilna i w krótkim czasie 3-aminoftalan przechodzi do stanu podstawowego, a nadwyżka energii zostaje oddana do środowiska w postaci promieniowania elektromagnetycznego. Jest to właśnie obserwowane w doświadczeniu niebieskie światło [6] [7] [8].
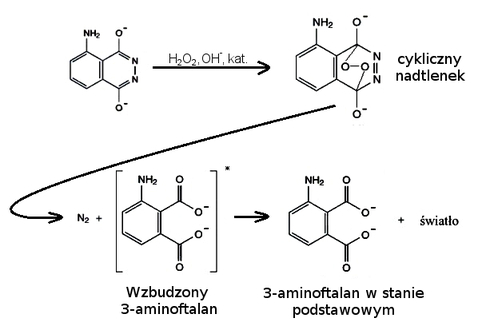
Rolę katalizatorów reakcji utleniania luminolu mogą pełnić rozpuszczalne w środowisku alkalicznym związki kompleksowe, np. żelaza(III), kobaltu(II) i miedzi(II). W opisywanym doświadczeniu korzystamy oczywiście z tej ostatniej możliwości. W reakcji metalicznej miedzi z wodnym roztworem amoniaku powstaje rozpuszczalny kompleks tetraaminamiedzi(II) [Cu(NH3)4]2+, który katalizuje reakcję, co objawia się widoczną chemiluminescencją.
Dosyć ważną funkcję w doświadczeniu pełni też wersenian disodowy. Jon wersenianowy wykazuje bardzo dużą zdolność do tworzenia z wieloma metalami związków kompleksowych, w których organiczny ligand łączy się z jonem metalu za pomocą więcej niż jednego wiązania koordynacyjnego (Rys.5). Kompleksy tego typu charakteryzują się wysoką trwałością i są nazywane chelatami [9].
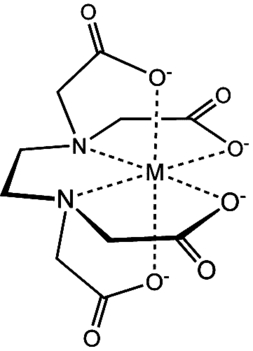
Dzięki tym właściwościom kwas wersenowy i jego sole znajdują wiele zastosowań. Są wykorzystywane w chemii analitycznej (kompleksometria), jako składniki buforów, konserwanty, inhibitory wielu enzymów i w charakterze odtrutki w zatruciach metalami ciężkimi.
Tworzący się w warunkach reakcji kompleks wersenianowy miedzi(II) jest bardziej trwały niż kompleks tetraaminamiedzi(II), ale nie katalizuje reakcji utleniania luminolu. Dzięki temu chemiluminescencja zachodzi jedynie w pobliżu powierzchni metalu, gdzie stężenie jonów [Cu(NH3)4]2+ jest odpowiednio wysokie. Gdybyśmy nie zastosowali czynnika kompleksującego, to po krótkiej chwili roztwór zacząłby świecić w całej objętości. Czas chemiluminescencji byłby stosunkowo krótki z powodu szybkiego zużycia całej dostępnej ilości luminolu. Zastosowanie wersenianu pozwala więc zarówno na wydłużenie czasu chemiluminescencji, jak i na otrzymywanie atrakcyjnych wizualnie efektów takich jak np. świecące napisy.
Literatura:
- [1] Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 17 powrót
- [2] Huntress E. H., Stanley L. N., Parker A. S., The preparation of 3-aminophthalhydrazide for use in the demonstration of chemiluminescence, Journal of the American Chemical Society, 56 (1), 1934, str. 241–242 powrót
- [3] Ples M., Synteza luminolu, w serwisie: http://www.weirdscience.eu, dostępne online: http://weirdscience.eu/Synteza%20luminolu.html [dostęp: 23.02.2015] powrót
- [4] Monety obiegowe, w serwisie: http://www.nbp.pl/, dostępne online: http://www.nbp.pl/home.aspx?f=/banknoty_i_monety/monety_obiegowe.html [dostęp: 23.02.2015] powrót
- [5] Juhani Hopkins J., Baudry G., Candolin U., Kaitala A., I'm sexy and I glow it: female ornamentation in a nocturnal capital breeder, Biology Letters, 2015, 11(10), str. 1-4 powrót
- [6] Podemska K., Orzeł A., Podsiadły R., Sokołowska J., Chemiluminescence – mystery of cold light, Chemik, 2013, 67(11), str. 1085–1096 powrót
- [7] White E.H., Zafiriou O., Kagi H.H., Hill J.H.M., Chemiluminescence of luminol: The chemical reaction, Journal of the American Chemical Society, 1964, 86, str. 940‒941 powrót
- [8] White E.H., Bursey M.M., Chemiluminescence of luminol and related hydrazides: The light emission Step, Journal of the American Chemical Society, 1964, 86, str. 941–942 powrót
- [9] Holleman A.F., Wiberg E., Inorganic Chemistry, Academic Press, San Diego, 2001 powrót
Marek Ples








