Pulsujące światło - Chemiluminescencyjne oscylacje
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (3/2019):

Istnieją pewne grupy reakcji chemicznych, które zawsze cieszą się wielkim zainteresowaniem uczniów i nauczycieli, nie tylko ze względu na niewątpliwą wartość edukacyjną, ale też wspaniały efekt wizualny. Obok innych należy tu wspomnieć reakcje, podczas których dochodzi do chemiluminescencji, czyli zjawiska emisji promieniowania elektromagnetycznego z zakresu światła widzialnego na drodze innej niż termiczna. Chemiluminescencja jest efektem zachodzenia specyficznych reakcji chemicznych. Chociaż tego typu procesy wydają się być czymś egzotycznym, to obok stosunkowo drogich, trudno dostępnych lub skomplikowanych w syntezie substancji takich jak np. lucyferyna robaczków świętojańskich Lampyris noctiluca C11H8N2O3S2, lucygenina C28H22N4O6 i tetrakis(dimetyloamino)etylen C10H24N4 można je zaobserwować także w odniesieniu do dużo łatwiejszych do zdobycia indywiduów chemicznych. Do zimnego świecenia zmusić można białą odmianę alotropową fosforu P, metaliczny sód Na i potas K, lofinę C21H16N2, tlen singletowy 1O2, polifenole wchodzące w skład zielonej herbaty, niektóre związki Grignarda i krzemoorganiczne (siloksen Wöhlera Si6O3H6 wytworzony ze zwykłego piasku), a nawet łatwo dostępny w aptekach manganian(VII) potasu [1] [2] [3] [4] [5]. Przedstawione wyliczenie w żadnym razie nie wyczerpuje tematu - znanych jest o wiele więcej chemiluminoforów, zarówno organicznych, jak i nieorganicznych.
Kolejną grupą interesujących i efektownych reakcji chemicznych są te, w czasie których dochodzi do samoorganizacji, co polega na spontanicznym powstawaniu w układzie uporządkowanych struktur lub korelacji czasowych. Procesy prowadzące do tego mogą być natury chemicznej, fizycznej lub łączyć obie z nich. Jednym z najwcześniej zbadanych przykładów samoorganizacji jest powstawanie charakterystycznych pierścieni opisanych dokładnie po raz pierwszy w 1896 roku przez Raphaela Eduarda Liseganga [6]. Jednym z przejawów samoorganizacji jest istnienie tzw. reakcji oscylacyjnych. Warto tu wspomnieć o bardzo interesujących reakcjach: Biełousowa-Żabotyńskiego i Briggsa-Rauschera [7]. Obie są dosyć często wykorzystywane w celach demonstracyjnych oraz edukacyjnych. Fotografia 1 przedstawia modyfikację reakcji B-Ż z wykorzystaniem ferroiny C36H24FeN62+, będącej barwnym wskaźnikiem redoks. Dzięki temu możemy obserwować cykliczną zmianę koloru roztworu pomiędzy czerwonym (środowisko redukujące), a niebieskim (środowisko utleniające).
Zarówno reakcje chemiluminescencyjne, jak i oscylacyjne są bardzo ciekawe i można z nich wyciągnąć bardziej ogólne wnioski na temat zależności opisujących otaczający nas świat. By jednak pójść o krok dalej, chciałbym zaproponować Szanownemu Czytelnikowi przeprowadzenie doświadczenia łączącego obie dziedziny: chemiluminescencyjnej reakcji oscylacyjnej!

Doświadczenie
By móc przeprowadzić doświadczenie potrzebujemy kilku substancji:
- rodanek potasu KSCN
- wodorotlenek sodu NaOH
- siarczan(VI) miedzi(II) pięciowodny CuSO4·5H2O
- nadtlenek wodoru 1M H2O2
- luminol (hydrazyd 3-aminoftalowy) C8H7N3O2
Rodanku potasu nie można zastąpić rodankiem amonu NH4SCN, podobnie dla nadania środowisku reakcji odczynu alkalicznego nie można zastąpić roztworu wodorotlenku sodu wodą amoniakalną, ponieważ jony amonowe NH4+ są inhibitorami przedstawionej dalej reakcji. Z tego samego powodu pozostałe odczynniki także nie mogą zawierać wspomnianych jonów.
Rodanek potasu, nazywany także tiocyjanianem potasu to nieorganiczny związek chemiczny z grupy rodanków, będący więc solą mało stabilnego w normalnych warunkach kwasu rodanowodorowego HSCN i potasu K. W temperaturze pokojowej jest to białe, krystaliczne ciało stałe (Fot.2).
Donorem potrzebnych w doświadczeniu jonów miedzi(II) Cu2+ będzie odpowiednia sól tego metalu, a konkretnie siarczan(VI) miedzi(II) w postaci pentahydratu. Jako sól uwodniona związek ten tworzy kryształy o niebieskiej barwie (Fot.3).
Siarczan(VI) miedzi(II) występuje w naturze jako minerał chalkantyt [8]. Substancja ta była znana już alchemikom, którzy często wykorzystywali ją w swoich pracach – nosiła wtedy miano witriolu miedzi (łac. Vitriol coeruleum). Nie jest przypadkiem, że nazwa ta jest akronimem łacińskiego motta popularnego wśród alchemików: Visita Interiora Terrae Rectificando Invenies Occultum Lapidem (odwiedź wnętrze Ziemi, dzięki oczyszczeniu znajdziesz tam ukryty kamień). Istnieją także inne wersje tego motta.
Ważną w doświadczeniu substancją jest też luminol, czyli 3-aminohydrazyd kwasu ftalowego. Wzór strukturalny tego związku przekonuje nas, że należy on do związków heterocyklicznych, tj. szerokiej klasy pierścieniowych związków chemicznych, w których co najmniej jeden układ cykliczny zawiera atom (lub atomy) pierwiastka innego niż węgiel (Rys.1).
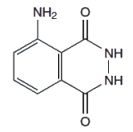
W warunkach normalnych luminol ma postać ciała stałego o barwie żółtawej do brązowej (Fot.4).
Znany z właściwości chemiluminescencyjnych luminol można nabyć w sklepach chemicznych, ale istnieje też inny sposób. Związek ten otrzymuje się w procesie syntezy etapowej, a substancją wyjściową jest kwas ftalowy lub jego bezwodnik. W szkolnym lub uczelnianym laboratorium można się pokusić o odpowiednią syntezę [9]. Uzyskanie pochodnej nitrowej wymaga użycia stężonego kwasu siarkowego(VI) H2SO4 i azotowego(V) HNO3, jest więc przy tym konieczne zachowanie daleko idącej ostrożności.
Wodorotlenek sodu wykorzystywany w opisanym doświadczeniu jest mocną zasadą i ma silne działanie żrące. Także nadtlenek wodoru może powodować w kontakcie z ciałem dotkliwe oparzenia. Luminol ma działanie alergogenne i jest podejrzewany o właściwości rakotwórcze. Rodanek potasu jest toksyczny, a w kontakcie z kwasami uwalnia silnie trujące gazy. Należy bezwzględnie unikać zanieczyszczenia oczu lub skóry – konieczne jest stosowanie odpowiednich środków ochrony osobistej.
Należy sporządzić cztery roztwory robocze według poniższego przepisu:
- A – 115 cm3 H2O2 (30%) uzupełnić wodą do objętości 1000 cm3 (powstały roztwór ma stężenie 1 mol/dm3),
- B – 14,55g KSCN w 100cm3 wody, następnie uzupełnić wodą do objętości 1000cm3,
- C – 0,15g CuSO4·5H2O w objętości 1000cm3,
- D – 4g NaOH w 100cm3 wody, rozpuścić 0,55 g luminolu, a następnie uzupełnić wodą do objętości 1000cm3 [10].
Do przygotowania wszystkich roztworów należy użyć wody destylowanej.
W charakterze roztworu A można zastosować też apteczną wodę utlenioną, jednak pociąga to za sobą zmiany okresu oscylacji z powodu spadku stężenia nadtlenku wodoru (około 0,88M, zamiast 1M). Tak czy inaczej wszystkie roztwory najlepiej przygotowywać na świeżo, ponieważ ich dłuższe przechowywanie może powodować problemy z powtarzalnością wyników eksperymentu, m.in. poprzez zmianę stężenia roztworu A na drodze spontanicznego rozkładu nadtlenku.
Przystępując do wykonania właściwego doświadczenia należy w odpowiednio dużym naczyniu zmieszać kolejno roztwory A, B, C i D w stosunku objętościowym 1:1:2:1. W moim przypadku wykorzystałem 120cm3 roztworów A, B i D, oraz 240cm3 roztworu C, co dało sumaryczną objętość 600cm3. Zwiększenie objętości powoduje wydłużenie czasu trwania oscylacji, więc może być korzystne.
Uzyskana mieszanina reakcyjna jest bezbarwna lub lekko żółtawa, jeśli luminol był niedokładnie oczyszczony, co się czasem zdarza. W czasie reakcji ciecz musi być silnie mieszana, co ma na celu zapewnienie jednorodności środowiska reakcji. Najlepiej nadaje się w tym celu mieszadło magnetyczne (Fot.5).
Po zmieszaniu roztworów należy zaciemnić pomieszczenie. Można wtedy zauważyć, że roztwór emituje dosyć słabe, niebieskie światło (Fot.6). Jest to etap indukcji, kiedy reakcja – czy raczej reakcje – w układzie już zachodzą, ale nie mają miejsca jeszcze oscylacje.
Indukcja zależnie od warunków może trwać od kilkunastu, kilkudziesięciu sekund do kilku minut.
W pewnym momencie roztwór na krótki czas – rzędu sekund – rozbłyskuje dużo jaśniejszym światłem, które szybko zanika. To znak, że rozpoczął się właściwy etap reakcji oscylacyjnej. Od tego momentu możemy zaobserwować rozbłyski światła przedzielone momentami wyraźnego (często prawie całkowitego dla nieuzbrojonego oka) spadku jasności chemiluminescencji roztworu. Przejścia między dwoma stanami są bardzo kontrastowe, co można zauważyć na Fot.7.
Okres oscylacji w temperaturze pokojowej i przy podanych stężeniach wynosi zwykle kilka minut. Drgania układu można przyspieszyć przez podgrzanie roztworu do temperatury około 40°C. Nie należy jednak przekraczać 55°C, ponieważ powoduje to zanik oscylacji. Gdyby oscylacje trwały zbyt krótko to można zwiększyć objętość roztworów – zachowując przy tym oczywiście wzajemny stosunek ich ilości.
Do doświadczenia można wprowadzić dającą ciekawy efekt modyfikację. Wykorzystamy w tym celu fluoresceinę C20H12O5 (Rys.2).
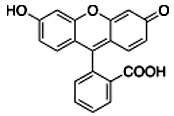
Pochodna ksantenu C13H10O nazywana fluoresceiną jest interesującym barwnikiem - w roztworach zasadowych wykazuje bardzo silną fluorescencję o barwie żółtozielonej. W normalnych warunkach ma ona postać czerwonych kryształków lub proszku (Fot.8). Z fluoresceiną należy postępować ostrożnie, ponieważ nawet najmniejszy, trudny do zauważenia gołym okiem kryształek tej substancji może spowodować powstanie trudnych do usunięcia plam na odzieży i innych materiałach.
Chcąc uzyskać proponowany efekt musimy dodać niewielką ilość barwnika do przygotowanej w ten sam sposób jak poprzednio mieszaniny reakcyjnej. Koncentrację barwnika trzeba dobrać doświadczalnie. Roztwór na świetle przyjmuje barwę jak na Fot.9.
W tym przypadku po czasie indukcji także możemy zaobserwować powstanie oscylacji chemicznych. Teraz rozbłyski światła będą miały intensywnie żółtozielony kolor zamiast niebieskiego (Fot.10).
Tak więc nawet niewielka zmiana wpływa znacząco na efekt wizualny. W ramach pokazu można uruchomić jednocześnie obie reakcje: bez i z dodatkiem fluoresceiny.
Wyjaśnienie
Przedstawiony proces jest modyfikacją reakcji, która została opisana po raz pierwszy w 1986 roku przez Miklósa Orbána, węgierskiego chemika. Stwierdził on, że w pewnych warunkach podczas reakcji między nadtlenkiem wodoru i rodankiem potasu katalizowanej związkami miedzi(II) może dochodzić do oscylacji chemicznych, objawiających się cykliczną zmianą zabarwienia roztworu, między bezbarwnym a żółto-brązowym [11].
Dwa lata później stwierdzono, że możliwe jest wprowadzenie do układu reakcyjnego luminolu będącego wydajnym chemiluminoforem [12]. Dzięki temu oscylacje mogą być obserwowane także w zakresie emisji światła charakterystycznego dla reakcji utleniania tej substancji.
Jak większość chemicznych procesów oscylacyjnych, także i ten jest dosyć skomplikowany. Wystarczy powiedzieć, że jeden z pierwszych postulowanych mechanizmów oscylacji chemiluminescencyjnych zakłada, że w roztworze zachodzi równolegle około 30 (sic!) regulujących się wzajemnie na różne sposoby reakcji, których opis wymaga zdefiniowania 26 związków pośrednich [13]. W toku dalszych badań model udało się uprościć do 9 zmiennych [14]. W każdym razie zachodzą tutaj cykliczne zmiany stężenia niektórych reagentów – w tym związków miedzi(II) np. w postaci hydroksykompleksów takich jak [Cu(OH)3]-.
Chemiluminescencja luminolu następuje w wyniku utleniania tego związku w środowisku alkalicznym. W ten sposób powstaje m.in. 3-aminoftalan. Istotne jest, że cząsteczka ta istnieje początkowo w stanie wzbudzonym, czyli o wysokiej energii. Sytuacja taka jest nietrwała, więc stan 3-aminoftalanu spontanicznie ulega szybko redukcji do podstawowego, a energia wzbudzenia zostaje (z pewnymi stratami) oddana do środowiska na drodze promienistej – co obserwujemy jako emisję niebieskiego światła. Ważne jest jednak, że samo utlenianie wymaga tutaj wykorzystania odpowiedniego katalizatora [15].
Wspomniane uprzednio związki miedzi(II) mogą pełnić rolę katalizatorów reakcji utleniania luminolu. Jest więc zrozumiałe, że świecenie roztworu będzie widoczne w postaci regularnych błysków odpowiadających maksimom stężeń odpowiednich kompleksów miedziowych. Analizując głębiej reakcję nie można jednak powstrzymać się od myśli, że zrozumienie czy nawet tylko próba opisu ogółu procesów uruchomionych w naczyniu reakcyjnym wcale nie jest prostym zadaniem.
Zmiana barwy świecenia roztworu pod wpływem dodatku fluoresceiny jest zrozumiała, jeśli weźmiemy pod uwagę zdolność cząsteczek tej substancji do oddawania energii wzbudzenia w postaci energii promienistej. Zasadowe roztwory wspomnianego związku fluoryzują nadzwyczaj mocno po wystawieniu na światło ultrafioletowe, ponieważ pochłaniają niesioną przez nie energię, a następnie oddają ją do środowiska w postaci promieniowania świetlnego o barwie żółtozielonej, tj. o długości fali większej niż światła pochłoniętego na skutek przesunięcia Stokesa. W roztworze zawierającym jakiegoś rodzaju cząsteczki w stanie wzbudzonym – np. powstający tutaj w czasie utleniania luminolu 3-aminoftalan – dochodzi do przeniesienia energii wzbudzenia na cząsteczki fluoresceiny, podczas powrotu których do stanu podstawowego następuje emisja żółtozielonego światła.
W przedstawionych reakcjach dochodzi do powstania korelacji czasowych w formie cyklicznych zmian stężeń pewnych substancji chemicznych. W procesach samoorganizacji może jednak mieć także miejsce powstawanie swoistych struktur przestrzennych. W reakcji Biełousowa-Żabotyńskiego z dodatkiem ferroiny prowadzonej w płytkim naczyniu o dużej powierzchni w odpowiednich warunkach można zaobserwować powstanie rozprzestrzeniających się (w praktycznie nieruchomym roztworze – nie dochodzi więc tutaj do transportu materii) fal zmiennego potencjału redoks (Fot.11).
Interesujące, że także w wypadku chemiluminescencyjnych oscylacji jest możliwe wypracowanie warunków, w których dochodzi do samoorganizacji przestrzennej. Można to zaobserwować jako chemiluminescencyjne fale reaktywności chemicznej. Procesy tego typu są w dalszym ciągu obiektem zainteresowania naukowców [16] [17].
Opisane doświadczenie jest bardzo efektowne i może być przyczynkiem do dalszych przemyśleń i dyskusji na temat samoorganizacji w ogóle. Dlatego do jego przeprowadzenia zachęcam każdego, kto ma tę możliwość.
Literatura:
- [1] Ples M., Błękitna poświata. Synteza i chemiluminescencja związku Grignarda, Chemia w Szkole, 6 (2017), Agencja AS Józef Szewczyk, str. 14-17 powrót
- [2] Ples M., Całkiem niezwykła herbatka, Chemia w Szkole, 4 (2015), Agencja AS Józef Szewczyk, str. 6-9 powrót
- [3] Ples M., Fiolet świeci - chemiluminescencja powszechnie dostępnego związku manganu, Chemia w Szkole, 6 (2018), Agencja AS Józef Szewczyk, 16-19 powrót
- [4] Ples M., Światło z retorty, Chemia w Szkole, 5 (2014), Agencja AS Józef Szewczyk, str. 33-34 powrót
- [5] Ples M., Chemiluminescencja metalicznego sodu, Chemia w Szkole, 1 (2014), Wydawnictwo EduPress, str. 5-7 powrót
- [6] Liesegang R.E., Eueber einige Eigenschaften von Gallerten, Naturwissenschaftliche Wochenschrift, 30(11), 1896, str. 353-362 powrót
- [7] Orlik M., Reakcje oscylacyjne - porządek i chaos, Wydawnictwa Naukowo-Techniczne, Warszawa, 1996 powrót
- [8] Gormaz G.G., Casanovas J.J., Atlas Mineralogii, Wiedza i życie, 1992 powrót
- [9] Huntress E. H., Stanley L. N., Parker A. S., The preparation of 3-aminophthalhydrazide for use in the demonstration of chemiluminescence, Journal of the American Chemical Society, 56 (1), 1934, str. 241-242 powrót
- [10] Prypsztejn H. E., Stratton D., Chemiluminescent Oscillating Demonstrations: The Chemical Buoy, the Lighting Wave, and the Ghostly Cylinder, Journal of Chemical Education, 82 (1), 2005, str. 53-54 powrót
- [11] Orban M., Oscillations and bistability in the copper(II)-catalyzed reaction between hydrogen peroxide and potassium thiocyanate, Journal of the American Chemical Society, 108(22), 1986, str. 6893-6898 powrót
- [12] Amrehn J., Resch P., Schneider F. W., Oscillating chemiluminescence with luminol in the CSTR [continuous flow stirred tank reactor], The Journal of Physical Chemistry, 92(12), 1988, str. 3318-3320 powrót
- [13] Brandl H., Albrecht,S., Haufe M., Neue Experimente zur Chemolumineszenz, Chemie in Unserer Zeit, 27(6), 1993, str. 303-305 powrót
- [14] Wiśniewski A., Pękala K., Orlik M. , Kinetic Model of the H2O2−SCN−−OH−−Cu2+ Oscillator and Its Application to the Interpretation of the Potentiometric Responses of Various Inert Electrodes Monitoring the Reaction Course, The Journal of Physical Chemistry A, 114(1), 2010, str. 183-190 powrót
- [15] Ples M., Widmowy blask. Chemiluminescencja katalizowana kompleksem miedzi, Chemia w Szkole, 2 (2016), Agencja AS Józef Szewczyk, str. 13-17 powrót
- [16] Wiśniewski A., Gorzkowski M. T., Pekala K., Orlik M., Thermokinetic Origin of Luminescent Traveling Fronts in the H2O2–NaOH–SCN––Cu2+ Homogeneous Oscillator: Experiments and Model, The Journal of Physical Chemistry A, 117(44), 2013, str. 11155–11166 powrót
- [17] Pękala K., Jurczakowski R., Lewera A., Orlik M., Luminescent Chemical Waves in the Cu(II)-Catalyzed Oscillatory Oxidation of SCN-Ions with Hydrogen Peroxide, The Journal of Physical Chemistry A, 111(18), 2007, str 3439–3442 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Opisane w artykule zjawisko udało mi się uchwycić na filmie:
Marek Ples










