Ciecz przechłodzona, albo gorący lód
By wiedzieć o co chodzi… parę podstaw teoretycznych
Jak wiemy materia w otaczającym nas świecie występuje najczęściej w jednym z trzech stanów skupienia (w uproszczeniu). Zaś stanem skupienia nazywamy podstawową formę, w jakiej występuje substancja. Forma ta określaja podstawowe własności fizyczne tej substancji w określonych warunkach. Własności substancji wynikają z układu oraz zachowania cząsteczek tworzących daną substancję. Bardziej precyzyjnym określeniem form występowania substancji jest faza materii.
Używany przez nas zwykle podział na trzy stany skupienia ma dosyć długi rodowód, ponieważ pochodzi z XVII wieku. Wyróżniamy więc:
- stały (ciało stałe)
- ciekły (ciecz)
- gazowy (gaz)
Podział ten wynika ze znacząco różnych właściwości substancji będących w każdym z tych trzech stanów:
- substancja w stanie stałym - posiada określoną objętość i kształt
- substancja w stanie ciekłym - posiada określoną objętość, ale nie kształt
- substancja w stanie gazowym - nie posiada określonej objętości ani kształtu
Występowanie większości substancji w danym stanie skupienia zależy od panującego ciśnienia i temperatury, np. woda pod ciśnieniem normalnym w temperaturze poniżej 0°C jest ciałem stałym, w temperaturach od 0 do 100°C jest cieczą, a powyżej 100°C staje się gazem.
W temperaturze krytycznej (krzepnięcia, wrzenia, topnienia, skraplania) następuje skokowa zmiana właściwości fizycznych ciała: ciecz zamienia się w gaz, ciało stałe w ciecz. Temperatury krytyczne są specyficzne dla danej substancji. Dzięki wiedzy na temat temperatury wrzenia możemy rozróżnić substancje różniące się tą własnością.
Okazuje się jednak, że jest możliwość utrzymania substancji w danym stanie skupienia, chociaż dzięki zmianie temperatury powinna już wystąpić zmiana tego stanu. Przykładem może być ciecz przechłodzona i ciecz przegrzana. Pierwsza jest ciągle cieczą, nawet poniżej temperatury zamarzania, zaś druga jest cieczą powyżej punktu wrzenia. Stany te są jednak metastabilne. Oznacza to, że są stabilne jeśli nie występuje jakieś naruszenie układu (wstrząs, zanieczyszczenie, wyładowanie elektryczne). W takim wypadku taka ciecz natychmiast przechodzi do stanu skupienia, jaki wynikałby bezpośrednio z temperatury (gwałtowne krzepnięcie lub wrzenie). Dziś zajmiemy się cieczą przechłodzoną.
Czego potrzebujemy?
By otrzymać ciecz przechłodzoną potrzebujemy octanu sodu, o wzorze CH3COONa. Jest to sodowa sól kwasu octowego, jej wzór strukturalny jest przedstawiony poniżej.
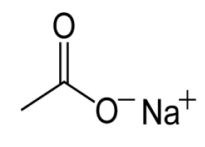
Można ją otrzymać w reakcji zobojętnienia kwasu octowego zasadą sodową. W temperaturze pokojowej octan sodu jest białą substancją krystaliczną:
W obecności wilgoci CH3COONa ulega częsciowo hydrolizie, dzięki czemu jest wyczuwalny delikatny zapach kwasu octowego. Związek ten występuje w formie hydratu.
Ostrzeżenie: Chociaż występujący w doświadczeniu octan sodu nie jest silną trucizną to należy zachować środki ostrożności jak zawsze przy pracy z chemikaliami. Należy zachować także ostrożność podczas podgrzewania. Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Najbardziej interesującą dla nas cechą tego związku jest to, że w temperaturze kilkudziesięciu stopni Celsjusza topi się on we własnej wodzie krystalizacyjnej. Jeśli stopiona ciecz jest czysta i znajduje się w naczyniu o gładkich ścianach to mimo spadku temperatury poniżej temperatury krzepnięcia pozostanie w stanie ciekłym!
Przystępujemy do pracy
Kryształy octanu sodu należy stopić. W tym celu do suchej i czystej probówki lub innego niewielkiego naczynia wsypujemy pewną ilość kryształów CH3COONa. Otwór wylotowy zatykamy watą, by nie nastąpiło zabrudzenie. Kurz doskonale pełni funkcję zarodków krystalizacji. Następnie probówkę wstawiamy do większego naczynia z wodą. Naczynie to stawiamy nad palnikiem. W warunkach domowych wystarczy kuchenka. Zaczynamy powoli podgrzewać (woda może delikatnie wrzeć). Po paru minutach nastąpi rozpuszczenie kryształów i otrzymamy przezroczystą ciecz, nieco gęstszą od wody. Dla pewności dobrze jest oczyścić ją przez sączenie. Możemy przeprowadzić je na sączku z niewielką ilościa waty. Przesączoną ciecz należy zebrać do także czystej i suchej probówki lub innego naczynia, które nalezy szybko zamknąć. Następnie musimy pozwolić substancji oziębić się.
Jeśli stopiony octan jest czysty to po powolnym ostudzeniu pozostanie w dalszym ciągu cieczą!
Wytrąćmy teraz z równowagi ten metastabilny układ. Natychmiastową krystalizację można rozpocząć w różny sposób: przez silne potrząśnięcie, zamieszanie cieczy szklaną bagietką czy wrzucenie do niej niewielkiego kryształu octanu:
Jak widzimy, początkowo substancja w probówce jest ciekła. Po wrzuceniu niewielkiego kryształka octanu sodu (zbyt mały by był widoczny na filmie) zaczyna się gwałtowna krystalizacja. Ciecz zamienia się w ciało stałe począwszy od góry. Po kilku sekundach cała zawartość probówki zamienia się w lity kryształ. Zostaje przy tym wydzielone ciepło, a probówka nagrzewa się do kilkudziesięciu stopni. Kryształy można ponownie przeprowadzić w stan ciekły na łaźni wodnej.
Przechłodzony octan sodu zestala się tak szybko, że wylewając go ze zlewki na podstawkę można formować krystaliczne figury! Zjawisko można też zastosować do unaocznienia sposobu powstawania stalagmitów. Poniżej zamieszczam mój filmik:
Fakt oddawania zakumulowanego przez ciecz przechłodzoną ciepła podczas jej gwałtownej krystalizacji wykorzystuje się w ogrzewaczach dłoni takich jak ten:

Jest to po prostu torebka wykonana z odpornego na temperaturę tworzywa sztucznego, która została wypełniona octanem sodu. Role inicjatora krzepnięcia pełni widoczna wewnątrz spręzynująca blaszka. Przy zginaniu jej jest wytwarzana nagła zmiana ciśnienia, która wytrąca ciecz z równowagi i zapoczątkowuje jej krystalizację. Oczywiście ogrzewacz można przywrócić do działania podgrzewając go w gorącej wodzie aż do stopienia substancji.
Napełniając stopionym octanem sodu niewielką, szczelnie zakręcaną buteleczkę otrzymamy własny ogrzewacz dłoni na zimę. Jest bardzo przydatny podczas marznięcia na przystankach autobusowych:
Krystalizację inicjujemy poprzez silne wstrząśnięcie buteleczki. Wkładamy ją do kieszeni gdy tylko rozpocznie się krystalizacja, co zapewni naszym dłoniom ciepło na jakiś czas.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Ahmad J., Crystallization from a Supersaturated Solution of Sodium Acetate, Journal of Chemical Education, 77 (11), 2000, str. 1446,
- Debenedetti P. G., Stanley H. E., Supercooled and Glassy Water, Physics Today, 56 (6), 2003, str. 40–46,
- Hiegel G. A., Crystallization of sodium acetate, Journal of Chemical Education, 57 (2),1980, str. 152,
- Moore E., Molinero V., Structural transformation in supercooled water controls the crystallization rate of ice, Nature, 479, 2011, str. 506–508.
Marek Ples


