Chemiluminescencja układu pirogalol-formaldehyd
Prosto z ciemni
Chemiluminescencja jest rodzajem luminescencji, w której promieniowanie widzialne powstaje w następstwie reakcji chemicznych. Są to reakcje egzoenergetyczne, więc energia wewnętrzna produktów jest niższa niż substratów. Zgodnie z zasadą zachowania, energia nie może zniknąć bezpowrotnie, ani powstać z niczego. Z tego powodu różnica energii reagentów musi zostać oddana do środowiska w tej czy innej formie. Najczęściej dzieje się to na sposób ciepła, ale w przypadku chemiluminescencji pewna część energii zostaje wypromieniowana w postaci promieniowania elektromagnetycznego o długości odpowiadającej światłu widzialnemu. Do substancji reagujących w ten sposób można zaliczyć singletową formę tlenu, lucyferynę, białą odmianę alotropową fosforu, lofinę i inne. Wiele z tych substancji jest stosunkowo drogich oraz trudnodostępnych (luminol lub szczawiany 2,4-dinitrofenylu i 2,4,6-trinitrofenylu). Samodzielna ich synteza też może nastręczać trudności chemikowi-amatorowi.
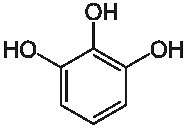
Nie ma jednak sytuacji bez wyjścia. Zatrzymajmy się przy substancji nazywanej pirogalolem. Jego nazwa systematyczna to 1,2,3-trihydroksybenzen, jest więc trihydroksylowym fenolem. Jego wzór strukturalny:
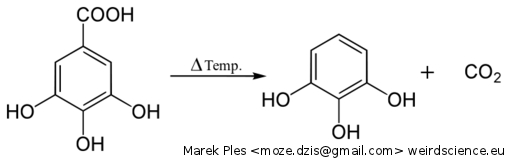
Związek ten jest stosunkowo łatwo dostępny i niedrogi. Można go też niezbyt trudno otrzymać przez dekarboksylację kwasu galusowego w podwyższonej temperaturze, na przykład w glicerolu lub glikolu etylenowym jako rozpuszczalniku:
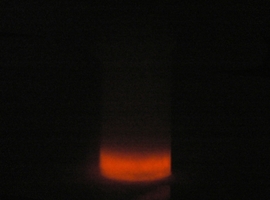
Co ma wspólnego pirogalol z luminescencją? Okazuje się, że całkiem sporo. Pirogalol był dawniej używany w fotografii jako wywoływacz. Fotografowie pracujący w ciemni zauważyli, że roztwory pirogalolu podczas utleniania delikatnie świecą!
Świecenie jest wyraźniejsze w przypadku nie samegu pirogalolu, lecz układu pirogalol-formaldehyd. Spróbujemy przeprowadzić właśnię tą reakcję.
Potrzebne materiały
Do przeprowadzenia doświadczenia potrzebujemy:
- pirogalol (1,2,3-trihydroksybenzen) C6H6O3,
- aldehyd mrówkowy, formalina HCHO 40%,
- nadtlenek wodoru H2O2 30%,
- węglan potasu K2CO3.
Ostrzeżenie: Pirogalol ma właściwości drażniące i żrące, możliwe jest też jego działanie mutagenne! Aldehyd mrówkowy jest silnie toksyczny, nie wolno wdychać jego par! Nadtlenek wodoru w stężeniu 30% jest silnie żrący i w kontakcie ze skórą powoduje bolesne, trudno gojące się rany oraz zmiany martwicze. W czasie pracy z wymienionymi substancjami konieczna jest ostrożność, trzeba używać środków ochrony osobistej, a pomieszczenie powinno być wyposażone w dobrze działającą wentylację. Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Wszystkie potrzebne substancje są widoczne na powyższym zdjęciu, trzeba bezwzględnie stosować się do zamieszczonej instrukcji bezpieczeństwa!
Doświadczenie
W dużej zlewce (500-1000cm3) przygotowujemy roztwór wlewając do niej:
- 5cm3 10% roztworu pirogalolu C6H6O3,
- 10cm3 nasyconego w temperaturze pokojowej roztworu węglanu potasu K2CO3,
- 5cm3 formaliny.
Tak przygotowany roztwór ma barwę brunatną, co widać poniżej.
Do roztworu wlewamy następnie 15cm3 30% roztworu nadltenku wodoru H2O2 (perhydrolu). Pomieszczenie zaciemniamy.
Po zmieszaniu roztwór zaczyna się silnie rozgrzewać, aż w końcu zaczyna wrzeć. Ulatniają się duże ilości wodoru i formaldehydu, dlatego pomieszczenie musi być wyposażone w sprawną wentylację! Co jednak najciekawsze, obserwujemy jednocześnie piękną, czerwoną poświatę. Jest to widoczne na poniższym zdjęciu z wydłużoną ekspozycją:
Wyjaśnienie
Wyjasnienie zachodzących tutaj procesów nie jest wcale łatwe. Według niektórych naukowców dochodzi tutaj do powstania singletowej formy tlenu, która wracając do stanu podstawowego emituje do otoczenia światło w zakresie podczerwieni i światła widzialnego. Doktor Tomasz Pluciński zwraca jednak uwagę w swojej książce "Doświadczenia chemiczne", że mechanizm reakcji musi być bardziej złożony. Mieszanina poreakcyjna jest słabo zabarwiona, podczas gdy utleniany pirogalol daje raczej ciemne zabarwienie. Prowadzi to do wniosku, że zachodzą tu także inne procesy, być może polikondensacja prowadząca do powstania jakiegoś rodzaju żywicy fenolowo-formaldehydowej. Nie jest to jednak w dalszym ciągu udowodnione ponad wszelką wątpliwość, a mechanizm reakcji jest dyskusyjny.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa
- Johnson L. D., Chemiluminescence or cold light investigations, Journal of Chemical Education, 17 (6), 1940, str. 295,
- Roesky H.W., Möckel K., Niezwykły świat chemii, Wydawnictwo Adamantan, 2001, str. 156-158,
- Shakashiri B. Z., Chemical Demonstrations. A Handbook for Teachers of Chemistry, University of Wisconsin Press, Madison, London, 1983, t.1, str. 175.
Marek Ples