W poszukiwaniu nadtlenku
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (3/2021):

Jedną z piękniejszych, moim oczywiście zdaniem, cech naszej materialnej rzeczywistości jest fakt, że chociaż wszystko co widzimy składa się ze stosunkowo niewielkiej liczby różnych pierwiastków (obecnie znamy ich około 118). Na drodze różnorodnego ich łączenia - a liczba możliwych kombinacji jest przecież ogromna – możemy uzyskać każdą istniejącą lub możliwą do otrzymania na drodze syntezy chemicznej substancję.
Mimo istnienia tak wielu połączeń chemicznych, istnieją substancje, które stosujemy w naszych pracowniach zdecydowanie częściej niż inne. Myślę, że nie będzie przesadą, że jako jedną z nich wymienię nadtlenek wodoru H2O2.
Wspomniana substancja jest nieorganicznym związkiem chemicznym z grupy nadtlenków i jednocześnie jedną z tak zwanych reaktywnych form tlenu [1]. Układ wiązań H–O–O–H w cząsteczce nadtlenku jest nieliniowy, podobnie zresztą jak układ H–O–H w wodzie.
Nadtlenek wodoru w temperaturze pokojowej jest lepką, prawie bezbarwną cieczą. Istnieją doniesienia, że przy wysokich stężeniach zbliżonych do 100% staje się niebieskawy. Jego temperatura topnienia jest nieco wyższa niż dla wody i wynosi −0,44°C, natomiast temperatura wrzenia to już około 150°C. Ma silne właściwości utleniające, co według niektórych źródeł wynika z z powstawania w czasie jego rozkładu silnie reaktywnego tlenu atomowego, tak zwanego tlenu in statu nascendi [2]. Czas istnienia tlenu w takiej formie jest jednak tak krótki, że dziś stawia się w wątpliwość jego rolę.
Czysty lub stężony nadtlenek wodoru jest bardzo nietrwały i może ulegać egzotermicznemu rozkładowi, który często przyjmuje formę wybuchową. Produktami rozkładu jest woda i tlen. Czynnikami wywołującymi tę reakcję może być obecność metali (w szczególności rozdrobionych i o silnie rozwiniętej powierzchni), światło ultrafioletowe oraz widzialne, wiele związków chemicznych, a nawet kontakt ze szkłem.
Nadtlenek wodoru to substancja wykazująca działanie żrące wobec żywych tkanek. Przy kontakcie ze skórą pozostawia białe martwicze plamy.
Roztwory o niewielkim stężeniu (ok. 3%, jako tzw. woda utleniona) są wykorzystywane w celach medycznych jako środki odkażające. Bardziej stężony nadtlenek wodoru znajduje zastosowanie jako wybielacz. Niebagatelną rolą jest także zastosowanie omawianej substancji jako utleniacza w wielu procesach chemicznych, prowadzonych zarówno na skalę laboratoryjną, jak i przemysłową.
Jako, że z nadtlenkiem wodoru mamy do czynienia całkiem dużo, to myślę, że warto poznać interesujący sposób wykrywania tej substancji. Bardzo przydatnym w tym celu odczynnikiem będzie siarczan(VI) tytanylu, o specyficznej strukturze – uwodniony kryształ TiOSO4∙H2O zawiera nieskończone zygzakowate łańcuchy Ti-O-Ti-O, z dopełnieniem koordynacji oktaedrycznej wokół każdego kationu za pomocą jednej cząsteczki wody i trzech jonów SO42-. Kationy TiO2+ istnieją zapewne tylko w roztworach wodnych (Rys. 1) [3] [4].
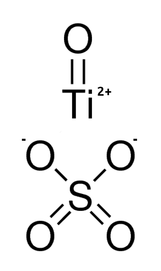
Aby móc zapoznać się z tym związkiem i możliwościami jakie nam daje jego wykorzystanie, musimy najpierw dokonać odpowiedniej syntezy.
Otrzymywanie
Aby dokonać syntezy siarczanu(VI) tytanylu potrzebujemy jedynie:
- kwas siarkowy(VI) H2SO4 (stężony),
- tlenek tytanu(IV) TiO2.
Szczęśliwie dla nas, wszystkie materiały są stosunkowo łatwo dostępne i ich cena nie jest zaporowa. Synteza według przedstawionego opisu nie nastręcza żadnych trudności w nawet podstawowo wyposażonej pracowni chemicznej [3].
Musimy pamiętać, że stężony kwas siarkowy(VI) jest silnie żrący i może wywoływać ciężkie oparzenia skóry i innych tkanek. Bezwzględnie konieczne jest zachowanie odpowiednich środków ochrony osobistej.
Tlenek tytanu(IV) o wzorze TiO2 jest nazywany inaczej bielą tytanową. W warunkach normalnych występuje jako proszek o temperaturze topnienia ok. 1830°C (Fot.1).
Tlenek tytanu(IV) jest najpowszechniej spotykanym i najtrwalszym tlenkiem tytanu [4]. Związek ten występuje naturalnie w trzech odmianach polimorficznych jako minerały anataz, brukit i rutyl. Tlenek tytanu(IV) znajduje zastosowanie jako trwały pigment o czystej białej barwie.
Przystępując do syntezy musimy odważyć i umieścić w probówce około 0,5g bieli tytanowej (Fot.2).
Do probówki wlewamy następnie kilka centymetrów sześciennych stężonego kwasu siarkowego(VI) i ostrożnie mieszamy. Objętość kwasu powinna być około dwa razy większa niż użytego tlenku.
Następną rzeczą jaką musimy zrobić, jest zamocowanie probówki w uchwycie na statywie. Pamiętajmy, że zawartość naczynia jest bardzo żrąca, a zdarza się, że probówka w czasie ogrzewania pęka. Dlatego ogrzewanie palnikiem musimy prowadzić umieszczając probówkę (pochyloną, wylotem skierowanym od nas) nad dużym naczyniem wypełnionym zimną wodą. Odpowiednia w tym celu jest miska lub spory krystalizator (Fot.3).
Mieszaninę ogrzewamy delikatnie do wrzenia. Trzeba koniecznie robić to pod sprawnie działającym wyciągiem lub na zewnątrz, ponieważ powstająca przy tym biaława para zawiera między innymi silnie trujące tlenki siarki.
Po chwili delikatnego wrzenia mieszaniny przerywamy ogrzewanie (Fot.4).
Mieszaninę trzeba następnie pozostawić do ostygnięcia i wlać jednym ruchem do około 500cm3 wody destylowanej, a potem wymieszać. Uzyskuje się zawiesinę pozostałego tlenku w kwaśnym roztworze (Fot.5).
Ostatnim etapem jest filtracja zawiesiny przez sączenie – wystarczy grawitacyjne na sączku celulozowym. Klarowny przesącz zbieramy do szczelnie zakręcanej butelki (Fot.6). Jest to roztwór pożądanego przez nas siarczanu(VI) tytanylu.
Trzeba zaznaczyć, że roztwór jest nietrwały i należy go chronić przed intensywnym światłem.
Wykrywamy nadtlenek wodoru
Aby przetestować działanie otrzymanego przed chwilą odczynnika, umieśćmy nieco silnie rozcieńczonego roztworu nadtlenku wodoru w probówce (Fot.7A). Możemy w tym celu wykorzystać apteczną wodę utlenioną – kilka centymetrów sześciennych uzupełnić wodą do takiej objętości, aby uzyskać stężenie zbliżone do 1%, a nawet niższe.
Do probówki wprowadzamy następnie kilka kropli roztworu siarczany tytanylu i mieszamy – zawartość probówki przyjmuje wtedy wyraźne zabarwienie żółte, co wskazuje na dodatni wynik próby i obecność nadtlenku wodoru w układzie (Fot.7B).
Opisana reakcja jest bardzo czuła i pozwala na wykrycie nawet śladowych ilości nadtlenku wodoru. Przy jego wyższych stężeniach barwa roztworu zbliża się do pomarańczowej, może także dochodzić do wytrącania się pomarańczowo-brunatnego osadu.
Wykorzystajmy poznaną metodę analityczną, by potwierdzić działanie procesu Thénarda. Nazwą tą określa się pierwszą, historyczną metodę otrzymywania nadtlenku wodoru, jaka została wdrożona na skalę przemysłową [5]. Potrzebujemy w tym celu nadtlenku baru BaO2, który w warunkach normalnych jest szarobiałym ciałem stałym (Fot.8).
Wodorotlenek baru jest utleniaczem stosowanym m.in. do bielenia i w pirotechnice. Jak zdecydowana większość pozostałych związków baru jest trujący, musimy więc zachować ostrożność.
Odważmy około 10g nadtlenku baru, po czym zalejmy je 15-20cm3 kwasu siarkowego(VI) o stężeniu 5%. Zawartość naczynia zamieszajmy i pozostawmy następnie na kilkanaście minut. Po tym czasie na dnie zlewki zbierze się nieco nierozpuszczalnego osadu (Fot.9).
Osad filtrujemy, zbierając klarowny przesącz (Fot.10).
Reakcję, która zaszła w układzie możemy opisać równaniem:
Jak widzimy, w reakcji nadtlenku baru z kwasem siarkowym(VI) otrzymaliśmy nierozpuszczalny osad siarczanu(VI) baru i nadtlenek wodoru. O jego obecności możemy przekonać się dodając do przesączu nieco roztworu siarczanu(VI) tytanylu – zgodnie z oczekiwaniami obserwujemy żółte zabarwienie (Fot.11).
W dzisiejszych czasach proces Thénarda został zastąpiony innymi technikami otrzymywania nadtlenku, między innymi metodą antrachinonową.
Ciekawym i mało znanym jest fakt, że podczas spalania wodoru w tlenie, poza produktem głównym jakim jest woda, powstają też niewielkie ilości nadtlenku wodoru – w odpowiednich warunkach nie jest trudno to zaobserwować [6]. W tym celu na kostkę wodnego lodu umieszczoną na szkiełku zegarkowym musimy skierować niewielki płomień wodoru palącego się w tlenie atmosferycznym (Fot.12). Płomień wodoru jest zwykle prawie niewidoczny i niebieskawy, ale na potrzeby zdjęcia został on zabarwiony na żółto jonami sodu. Pochodzą one z łatwotopliwego szkła stanowiącego materiał dyszy przez którą uchodzi wodór – jest to po prostu najzwyczajniejsza szklana pipeta Pasteura.
Przy wykorzystaniu wodoru musimy pamiętać o niebezpieczeństwach, jakie są z tym związane. Podpalać możemy jedynie czysty wodór, nie zanieczyszczony powietrzem. Mieszaniny tlenu z powietrzem lub tlenem są łatwopalne i wybuchowe – najniebezpieczniejsze są te, w których stosunek masowy obu składników jest identyczny z występującym w wodzie (mieszanina piorunująca).
Po chwili, kiedy z kostki wytopieniu uległo kilka centymetrów sześciennych lodu, przerywamy ogrzewanie (Fot.13A). Jeśli do wytopionej wody wprowadzimy nieco soli tytanylu, zauważymy wystąpienie żółtego zabarwienia potwierdzającego obecność nadtlenku wodoru (Fot.13B). Jest ono zwykle nieco bledsze niż w poprzednich przypadkach z racji niewielkiego stężenia wykrywanej substancji.
Powstająca w wyniku spalania wodoru woda i nadtlenek wodoru ulegają skropleniu w kontakcie z lodem. Doświadczenie to jest nieco kapryśne i ze względu na znikome ilości powstającego nadtlenku nie zawsze się udaje.
Można też inaczej
Inną, częściej wykorzystywaną metodą wykrywania obecności nadtlenku wodoru, a także innych nadtlenków jest wykorzystanie zakwaszonego roztworu jodku sodu lub potasu. Aby to sprawdzić, musimy przygotować kilkuprocentowy roztwór któregoś ze wspomnianych jodków w wodzie destylowanej delikatnie zakwaszonej np. kwasem siarkowym(VI). Opisany roztwór jest bezbarwny i klarowny. Po dodaniu choćby odrobiny nadtlenku wodoru roztwór barwi się na żółto-pomarańczowo, czy nawet brązowo pod wpływem powstającego pierwiastkowego jodu (Fot.14).
Metodę można delikatnie zmodyfikować, wprowadzając do układu nieco roztworu skrobi ziemniaczanej – dzięki tworzeniu z nią granatowego kompleksu możemy zaobserwować wyraźnie efekt nawet przy wydzieleniu się stosunkowo niewielkich ilości wolnego jodu (Fot.15).
Pierwiastkowy jod powstaje tutaj na drodze reakcji:
Próba z jodkami, chociaż mniej kłopotliwa, to jest zdecydowanie mniej czuła niż próba z siarczanem(VI) tytanylu.
Wyjaśnienie
Przeprowadzoną przez nas reakcję otrzymywania omawianego związku opisuje się zwykle jako proces dwuetapowy. Początkowo tlenek tytanu(IV) reaguje z kwasem siarkowym(VI) dając w wyniku siarczan(VI) tytanu(IV):
Powstały siarczan(VI) tytanu(IV) reaguje w kwaśnym roztworze dalej z wodą:
Uzyskujemy więc uwodniony siarczan(VI) tytanylu o wzorze TiOSO4•H2O [7]. Stanowi to jednak jedynie przybliżenie, ponieważ w rzeczywistości substancja ta tworzy przestrzenną strukturę polimeryczną [8]. Tworzenie żółtego produktu w reakcji z nadtlenkiem wodoru zapisuje się często w uproszczeniu – szczególnie w dawniejszych opracowaniach - jako reakcję powstawania siarczanu(VI) nadtlenotytanylu:
Dziś jednak produkt reakcji traktuje się powszechnie jako związek kompleksowy.
Mam nadzieję, że przedstawione doświadczenia przysłużą się Czytelnikowi do wzbogacenia jego pracowni o jeden nowy, przydatny odczynnik i metodę analizy.
Literatura:
- [1] Bartosz G., Druga twarz tlenu, Wydawnictwo Naukowe PWN, Warszawa, 2008, str. 28 i 46 powrót
- [2] Nadtlenek wodoru, w: Encyklopedia techniki - Chemia, Gajewski W. (red.), Wydawnictwa Naukowo-Techniczne, Warszawa, 1965, str. 449 powrót
- [3] Waselowsky K., 225 doświadczeń chemicznych, Wydawnictwa Naukowo-Techniczne, Warszawa, 1987, str. 41 powrót
- [4] Hassa R., Mrzigod J., Podręczny słownik chemiczny (wyd. I), Videograf II, Katowice, 2004, str. 55 powrót
- [5] Goor G., Glenneberg J., Jacobi S., Hydrogen Peroxide, w: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley, Weinheim, 2007 powrót
- [6] Waselowsky K., 225 doświadczeń chemicznych, Wydawnictwa Naukowo-Techniczne, Warszawa, 1987, str. 42 powrót
- [7] Brauer G., Handbuch der Präparativen Anorganischen Chemie - 3, Ferdinand Enke, Stuttgart, 1978 powrót
- [8] Gatehouse B. M., Platts S. N., Williams T. B., Structure of Anhydrous Titanyl Sulfate, Titanyl Sulfate Monohydrate and Prediction of a New Structure, Acta Crystallographica Section B. 49, 1993, str. 428-435 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Marek Ples














