Oscylacyjna reakcja Briggsa-Rauchsera
Ciągłe zmiany
O reakcjach samoorganizacji oraz oscylacyjnych pisałem już wielokrotnie; opisałem m.in. pierścienie Lieseganga i reakcję Biełousowa-Żabotyńskiego.
Reakcja ta pozwala bardzo wyraziście zaobserwować fakt zachodzenia w układzie reakcyjnym drgań. Kolejno następujące po sobie fazy reakcji charakteryzują się kontrastującymi ze sobą, doskonale widocznymi barwami.
Jak przeprowadzić tą zaskakującą reakcję? Jeśli chcesz się tego dowiedzieć, szanowny Czytelniku, to zapraszam do dalszej lektury.
Potrzebne materiały
Tym razem potrzebujemy nieco większej niż zwykle ilości różnych substancji chemicznych:
- Kwas siarkowy(VI) H2SO4 o stężeniu 1mol/dm3,
- jodan potasu KIO3,
- kwas malonowy C3H4O4,
- siarczan manganu(II), monohydrat MnSO4·H2O,
- nadtlenek wodoru H2O2 30%,
- skrobia.
Ostrzeżenie: Kwas siarkowy(VI) oraz nadtlenek wodoru są silnie żrące i powodują ciężkie oparzenia! Jodan potasu i siarczan manganu(II) są toksyczne, a kwas malonowy ma działanie drażniące. Trzeba zachować ostrożność i stosować środki ochrony osobistej! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Można zastosować skrobię rozpuszczalną lub zwykłą mąkę ziemniaczaną. Skrobię ziemniaczaną należy rozmieszać we wrzącej wodzie.
Posiadając już potrzebne substancje możemy przystąpić do eksperymentu.
Doświadczenie
Najpierw musimy przygotować dwa roztwory. Ich skład:
- A - 20cm3 wody destylowanej, 1cm3 kwasu siarkowego(VI) H2SO4 o stężeniu 1mol/dm3, 150mg jodanu potasu KIO3, 150mg siarczanu manganu(II) MnSO4·H2O, 100mg kwasu malonowego C3H4O4, 1cm3 roztworu skrobi o stężeniu 1%
- B - 4,5cm3 H2O2 o stężeniu 30%, 9cm3 wody destylowanej
Zwracam uwagę, że dokładne odważanie i odmierzanie potrzebnych ilości odczynników ma tutaj kluczowe znaczenie! Nawet niewielkie odstępstwa mogą spowodować, że doświadczenie się nie uda. Eksperyment ten ze swej natury jest dosyć kapryśny i nawet przeprowadzony idealnie według wskazówek nie zawsze się udaje. Wtedy nie można się zrażać i najlepiej po prostu go powtórzyć. W końcu się na pewno uda.
Przystępując do doświadczenia musimy zmieszać roztwory w kolbie odpowiedniej wielkości. Warunkiem efektywnego zajścia reakcji jest ciągłe mieszanie, najwygodniej posłużyć się mieszadłem magnetycznym.
Po zmieszaniu obu roztworów bezbarwna mieszanina reakcyjna nabiera najpierw barwy złocistej, a następnie gwałtownie zmienia kolor na granatowy. Potem następuje ponownie odbarwienie roztworu i cały cykl się zamyka. Poniższe zdjęcia przedstawiają kolejne fazy reakcji.
Oscylacje trwają zwykle kilkanaście minut i są niezwykle efektowne:

Okres drgań układu zależy w dużej mierze od temperatury: zmniejsza się wraz z jej wzrostem.
Wyjaśnienie
W trakcie reakcji nie dochodzi do powstania równowagi i proces przechodzi cyklicznie przez kilka kolejnych stanów, czego widocznym efektem jest zmiana barwy. W oscylującym roztworze zachodzi wiele równoległych i powiązanych ze sobą reakcji. Po dokładny opis zachodzących tutaj procesów odsyłam do odpowiedniej literatury.
W uproszczeniu dochodzi tutaj do reakcji między jonem jodanowym, nadtlenkiem wodoru i kwasem malonowym. Pierwszy etap reakcji:

Powstaje tutaj kwas jodowy(I) HOI, który reaguje następnie z kwasem malonowym według równania:
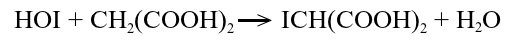
Reakcja tworzenia kwasu jodowego(I) HOI jest w tych warunkach szybsza niż tempo jego zużywania w reakcji z kwasem malonowym. Powstaje więc niewielki jego nadmiar, który może reagować z nadtlenkiem wodoru:

Z kolei powstający jon jodkowy może reagować dalej. Powstaje wtedy pierwiastkowy jod odpowiedzialny za złocistą barwę.
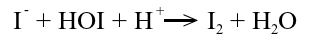
Powstający jod wiąże się ze skrobią dając intensywnie granatowy kompleks. Jednocześnie powstały jod jest zużywany w reakcji:

Sól manganu jest katalizatorem umożliwiającym zajście reakcji.
Przedstawiony mechanizm pokazuje jedynie główne reakcje zachodzące w roztworze i nie tłumaczy jeszcze dlaczego powstają oscylacje. Zjawisko to nie jest jeszcze w pełni wytłumaczone, prawdopodobnie są to dwa sprzężone chemiczne układy drgające.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa
- Bray W. C., A Periodic Reaction in Homogeneous Solution and Its Relation to Catalysis, Journal of the American Chemical Society, 1921, 43(6), str. 1262–1267
- Briggs T.S., Rauscher W.C., An Oscillating Iodine Clock, Journal of chemical Education, 1973, 50, str. 496
- Degn H., Oscillating Chemical Reactions in Homogeneous Phase, Journal of chemical Education, 1972, 49, str. 302–307
- Pluciński T., Doświadczenia Chemiczne, Wydawnictwo Adamantan, Warszawa, 1997, str. 85-86
- Shakhashiri B.Z., Chemical Demonstrations: A Handbook for Teachers of Chemistry, Vol. II, University of Wisconsin Press, 1992, str. 248–256
Marek Ples


