Trijodek azotu
Bardzo wrażliwa substancja
Na wstępie chciałbym zaapelować do Czytelnika o ostrożność. Synteza i manipulacje z trijodkiem azotu mogą być bardzo niebezpieczne. Pokaz ten mogą przeprowadzać tylko doświadczeni chemicy z zachowaniem wszelkich możliwych środków ostrożności! Nigdy nie należy operować większymi ilościami ten substancji!
Nie wolno przechowywać trijodku azotu, dlatego dopuszczalne jest wytwarzanie jedynie minimalnych ilości, które zostaną natychmiast zużyte w celach pokazowych. Niedopuszczalne jest wykorzystywanie go w żadnym innym celu!
Trijodek azotu to nieorganiczny związek chemiczny azotu i jodu. Jest to ekstremalnie niestabilna substancja. Związek ten rozkłada się w sposób wybuchowy pod wpływem nawet nikłych bodźców mechanicznych. Inicjacja reakcji rozkładu jest możliwa także pod wpływem naprężeń powstających w czasie tworzenia się kryształów. Trijodek azotu jest jedyną znaną do tej pory substancją, której rozkład może zostać wywołany przez kontakt z cząstkami będącymi produktami rozpadu promieniotwórczego.
Czysty trijodek azotu NI3 można uzyskać w reakcji fluorku jodu z azotkiem baru w środowisku trichlorofluorometanu w temperaturze około 240K. Nas ta reakcja nie zadowala, ponieważ potrzebne reagenty są trudno dostępne i drogie. Trijodek azotu można też otrzymać w postaci analogicznego do hydratów amoniakatu NI3•NH3. Związek ten łatwo wytworzyć w reakcji jodu i wody amoniakalnej w temperaturze pokojowej. Właśnie tą reakcję wykorzystamy do zsyntezowania niewielkich ilości NI3•NH3.
Czego potrzebujemy?
By przeprowadzić doświadczenie musimy się zaopatrzyć w poniższe substancje:
- jod I,
- woda amoniakalna 30% NH3
Woda amoniakalna ma różnorodne zastosowanie i jej nabycie nie powinno być problemem. Jeśli chodzi o jod, to najlepiej użyć fioletowoczarnych kryształów czystego jodu (na poniższym zdjęciu) lub w ostateczności alkoholowego roztworu jodu, czyli dostępnej w aptekach jodyny.
Oprócz tego będzie nam potrzebny także etanol, który posłuży do przemycia odsączonego produktu.
Ostrzeżenie: Czysty jod jest trujący! Dawka śmiertelna dla dorosłego człowieka wynosi około 4 gramy. Pary jodu są drażniące. Amoniak ulatniający się z wody amoniakalnej jest także drażniący, a w większych stężeniach trujący. Trijodek azotu jest ekstremalnie czuły na bodźce mechaniczne; może eksplodować w wyniku lekkiego dotyku, wstrząsu, a nawet pod wpływem ruchu mas powietrza. Należy zachować szczególną ostrożność, a wszelkie manipulacje z substancją wykonywać w stanie zwilżonym. Nie można syntezować jodku azotu w ilości większej niż minimalna konieczna do pokazu. Trzeba stosować środki ochrony osobistej. Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Pokaz!
Do niewielkiej zlewki wlewamy kilka cm3 stężonej wody amoniakalnej. Następnie wsypujemy do roztworu dosłownie szczyptę jodu! Wystarczy kilka miligramów. Jeśli używamy jodyny, to wkraplamy do wody amoniakalnej jedynie taką jej ilość by powstał czarny osad. Zlewkę nakrywamy szkiełkiem zegarkowym i odstawiamy na pewien czas.
Od tego momentu wszelkie manipulacje ze zlewką i powstałym produktem należy wykonywać bardzo ostrożnie i nie powodować żadnych wstrząsów!
Po pewnym czasie roztwór trzeba delikatnie przesączyć. Odsączony czarny związek można kilkuktrotnie przemyć na sączku etanolem w celu wymycia pozostałości jodu. Wciąż wilgotny sączek należy następnie ostrożnie rozłożyć na metalowej płytce i pozostawić do wyschnięcia. Gotowy produkt ma postać czarnego proszku:
Dotknięcie proszku spowoduje teraz głośny huk. Najlepiej użyć w tym celu długiego drewnianego pręta. Efekt można zobaczyć na poniższej animacji:

Huk jest bardzo głośny; należy chronić przed nim słuch. W czasie eksplozji powstaje także duża ilość brunatnych par.
Wyjaśnienie
Wysoką niestabilność trijodku azotu można tłumaczyć dążeniem do utworzenia bardzo trwałej cząsteczki azotu N2. Rozkład amoniakatu zachodzi według poniższego równania.
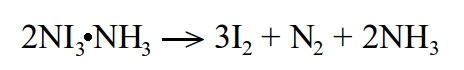
Powstały jod tworzy brunatny dym.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa:
- Bowden, F. P., The initiation of explosion by neutrons, α-particles, and fission products, Proceedings of the Royal Society of London A: Mathematical, Physical and Engineering Sciences, 246 (1245), 1958, str. 216-219,
- Kaiho T., Iodine Chemistry and Applications, Wiley, 2014, str. 59,
- Tornieporth-Oetting I., Klapötke T., Nitrogen Triiodide, Angewandte Chemie International Edition, 29 (6), 1990, str. 677–679.
Marek Ples

