Świecący cukierek - fosforyzujące układy organiczne
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Chemia w Szkole (6/2019):

Zjawiska, którym towarzyszy świecenie cieszą się szczególnym zainteresowaniem samych uczniów, jak i ich nauczycieli. Jest to związane z tym, że w ten sposób można się przekonać naocznie o istnieniu molekularnych mechanizmów rządzących naszym światem. Takie doświadczenie z pewnością łatwiej i szybciej trafia do wyobraźni, niż samo opracowanie teoretyczne. Nie bez znaczenia jest też fakt, że interesujący efekt wywołuje zaciekawienie i dążenie do jego zrozumienia. A to jest przecież istotą nauki! Dlatego w tym artykule chciałbym omówić właśnie takie fascynujące zjawisko.
Fosforescencja jest jednym z typów luminescencji, to jest procesów, w których dochodzi do powstania promieniowania elektromagnetycznego z zakresu światła widzialnego. Zjawisko to polega na emisji światła przez niektóre substancje w efekcie uprzedniego naświetlenia promieniowaniem o określonej długości fali, a co za tym idzie, także o odpowiedniej energii. Czas fosforescencji jest stosunkowo długi, a jej trwanie mierzy się w okresach rzędu od pojedynczych sekund do wielu godzin. Odróżnia to fosforescencję od fluorescencji, która jest podobnym zjawiskiem, lecz w jej przypadku emisja światła ustaje niemal natychmiast (w czasie rzędu 10-8 s) po ustaniu działania czynnika wzbudzającego.
Fosforescencję wykazuje wiele substancji, na przykład domieszkowane solami metali ciężkich siarczki cynku i berylowców, glinian (rzadziej w literaturze nazywany aluminianem) strontu SrAl2O4, czy azotki glinu i boru [1]. Materiały te są jednak często stosunkowo kłopotliwe w otrzymywaniu, a dostępność do nich może być utrudniona. Istnieje jednak sposób otrzymywania substancji fosforescencyjnych na tyle prosty, że można go wypróbować w domowym lub szkolnym laboratorium.

Doświadczenie
Ostrzeżenie: w przedstawionych doświadczeniach nie są wykorzystywane żadne silnie toksyczne substancje, ale trzeba jak zawsze zachować ostrożność. Ekspozycja na duże dawki mleczanu etakrydyny i fluoresceiny może mieć negatywny wpływ na zdrowie. Obie substancje są także wydajnymi barwnikami i z łatwością plamią odzież lub skórę. Szczególnie niebezpieczne jest ogrzewanie do roztopienia mieszaniny cukrów, ponieważ oparzenia tego rodzaju lepką cieczą są trudne w leczeniu. Należy zawsze korzystać z odpowiednich środków ochrony osobistej!
Potrzebne są jedynie łatwe do zdobycia substancje chemiczne:
- cukier (mieszanina glukozy i fruktozy),
- mleczan etakrydyny C18H21N3O4 [2].
Jeśli chodzi o cukry, to najlepiej wykorzystać cukierek typu landrynki, w skład którego - poza bardzo niewielkimi ilościami dodatków smakowych i barwników - wchodzą właśnie wspomniane węglowodany. Syrop skrobiowy stosowany jako dodatek do cukierków skutecznie powstrzymuje krystalizację cukru, która mogłaby przeszkadzać w doświadczeniu.
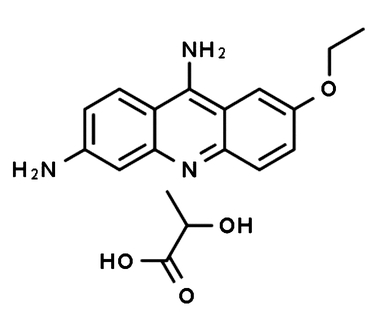
Mleczan etakrydyny jest substancją o właściwościach odkażających i można go kupić w aptece, pod nazwą rywanol. Strukturę cząsteczki tego wydajnego barwnika fluorescencyjnego przedstawia Rys.1 [3].
Jeden cukierek należy pokruszyć (Fot.1). Nie ma tu szczególnego znaczenia barwa samego cukierka, ale ze względów praktycznych lepiej wybierać te o jasnych barwach, najlepiej przejrzyste.
Mieszaninę cukrów trzeba dokładnie wymieszać z małą szczyptą, dosłownie kilkoma miligramami mleczanu etakrydyny mającego postać żółtego proszku (Fot.2).
Tak otrzymaną mieszaninę należy ogrzewać aż do stopienia nad palnikiem alkoholowym, gazowym lub przy wykorzystaniu elektrycznej płyty grzejnej. Ogrzewanie trzeba prowadzić w niezbyt wysokiej temperaturze, stosunkowo powoli, tak by nie doprowadzić do wyraźnego zwęglenia cukrów, czyli karmelizacji. Z tego powodu konieczne jest też ciągłe mieszanie. Wraz ze wzrostem temperatury mieszanina staje się coraz bardziej płynna, a jej lepkość spada. Upłynnioną masę trzeba jeszcze mieszać przez minutę lub dwie, po czym wylać na zimną powierzchnię, najlepiej pokrytą spożywczą folią aluminiową.
Po ochłodzeniu otrzymujemy szklisty stop (Fot.3), zabarwiony rywanolem na zielony kolor. Na wszelki przypadek nadmienię, że tak otrzymany „cukierek” nie jest już jadalny.
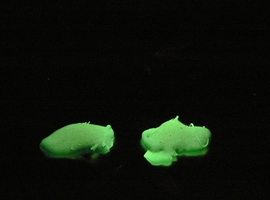
Na świetle stop nie przejawia jakichś specjalnych właściwości. Wystarczy go jednak naświetlić światłem żarówki, a następnie szybko usunąć źródło światła. Można zaobserwować wtedy trwającą kilka do kilkunastu sekund, zadziwiająco intensywną fosforescencję barwy jasnozielonej (Fot.4).
Do naświetlania najlepiej stosować światło o jak najwyższej energii. Naświetlanie monochromatycznym światłem czerwonym nie daje żadnych efektów, w przeciwieństwie do monochromatycznego światła niebieskiego - czy raczej fioletowego (λ=405nm) - pochodzącego z półprzewodnikowego lasera, które daje efekt dużo silniejszy niż światło żarówki (Fot.5). Także czas dostrzegalnej fosforescencji jest wtedy wyraźnie dłuższy.
Proces naświetlania można powtarzać wielokrotnie, za każdym razem obserwując fosforescencję. Należy jednak pamiętać, że otrzymany stop jest higroskopijny – należy go chronić przed wilgocią.
Możemy wykonać także inny organiczny układ zdolny do fosforescencji. Musimy w tym celu zgromadzić:
- alkohol poliwinylowy [CH2CH(OH)]n,
- fluoresceinę C20H12O5.
Alkohol poliwinylowy jest syntetycznym polimerem złożonym z reszt alkoholu winylowego C2H4O. Co ciekawe, najczęściej jednak otrzymuje się go z poli(octanu winylu) o wzorze sumarycznym (C4H6O2)n. Omawiany związek ma bardzo szerokie zastosowanie w przemyśle chemicznym i farmaceutycznym. W warunkach normalnych wykorzystana przeze mnie próbka (masa molowa = 80000 g/mol) miała postać drobnych białych kryształów widocznych na Fot.6 .
Z kolei fluoresceina jest pochodną ksantenu C13H10O (Rys.2). W środowisku zasadowym wykazuje zielonożółtą fluorescencję. Związek ten jest bardzo wydajnym barwnikiem, także fluorescencyjnym - świecenie roztworu tej substancji oświetlonego światłem ultrafioletowym jest widoczne nawet przy rozcieńczeniu rzędu jednego do kilkudziesięciu milionów.
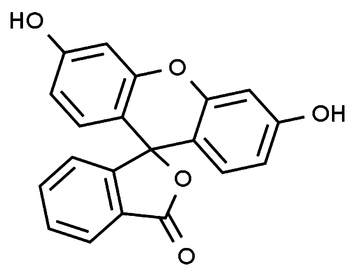
Fluoresceina jest pomarańczowoczerwoną substancją krystaliczną (Fot.7). Bywa dostępna także w formie soli sodowej noszącej nazwę uraniny.
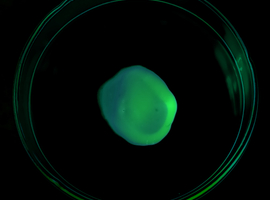
Musimy teraz przygotować roztwór alkoholu poliwinylowego w kilkunastu, kilkudziesięciu centymetrach sześciennych wody destylowanej. Uprzedzam, że związek ten rozpuszcza się dosyć opornie w wodzie, a cały proces należy prowadzić na ciepło – konieczne jest też intensywne mieszanie. Alkoholu należy dodać w takiej ilości, aby powstały roztwór miał postać lepkiej cieczy. Do tak otrzymanego roztworu trzeba następnie wprowadzić szczyptę fluoresceiny i kontynuować mieszanie. Ewentualne nierozpuszczalne pozostałości musimy odsączyć – przydatny jest zestaw do sączenia próżniowego. Uzyskany płyn na świetle widzialnym ma barwę pomarańczową, jednak po oświetleniu światłem UV wspaniale fluoryzuje na zielono (Fot.8).
Płyn trzeba teraz pozostawić do wyschnięcia w temperaturze pokojowej lub nieco wyższej, np. na grzejniku. Po odparowaniu wody i dokładnym wysuszeniu pozostaje cienka, żółtawa błonka zbudowana z alkoholu poliwinylowego i niewielkiej domieszki fluoresceiny (Fot.10).
Błonka fluoryzuje w świetle UV i podobnie jak poprzednio uzyskane szkliwo cukrowe z rywanolem fosforyzuje po naświetleniu (Fot.11).
Interesujący efekt uzyska się także nasączając roztworem alkoholu poliwinylowego papier lub bibułę i wysuszając go. Po takim papierze można w ciemności „rysować” za pomocą promienia wskaźnika laserowego (światło o barwie niebieskiej lub fioletowej), ponieważ pozostawia on świecące przez pewien czas ślady.
Wyjaśnienie
Jak wyjaśnić zachodzące tutaj zjawiska? Większość zjawisk luminescencyjnych - opierających się na absorpcji energii promienistej, a następnie ponownej jej emisji - trwa bardzo krótko, bo jedynie do 10 nanosekund. W przypadku fluorescencji przeskok elektronów z poziomu wzbudzenia do stanu podstawowego zachodzi bezpośrednio, w bardzo krótkim czasie.
W przypadku fosforescencji absorpcja promieniowania o określonej długości fali powoduje, podobnie jak w fluorescencji, wzbudzenie cząsteczki barwnika do jednego z singletowych stanów wzbudzonych. Następnie dochodzi w czasie rzędu pikosekund do przejść oscylacyjno-rotacyjnych VR, kiedy część energii wzbudzenia zostaje rozproszona w postaci ciepła. W czasie kolejnych procesów cząstka zostaje sprowadzona do niższego singletowego stanu wzbudzonego. Dla materiałów wykazujących fosforescencję zachodzi wtedy częste przejście międzysystemowe ISC ze stanu singletowego do trypletowego. Według kwantowej reguły wyboru jednak tylko przejścia między stanami o tej samej multipletowości zachodzą z dużym prawdopodobieństwem. Przejście do stanu podstawowego jest więc utrudnione z racji małego prawdopodobieństwa takiego przejścia i dzięki temu proces ten może trwać dłuższy czas po ustaniu wzbudzenia. Powrót cząsteczki do elektronowego stanu podstawowego następuje - po ponownej utracie części energii w trakcie przejść wibracyjnych VR - w procesie fosforescencji. Obserwujemy to jako zanikającą szybciej lub wolniej poświatę. Pozostała część energii zostaje wtedy oddana do środowiska w postaci promieniowania elektromagnetycznego z zakresu światła widzialnego.
Z racji strat energii długość fali światła emitowanego w procesie fosforescencji jest zawsze dłuższa niż długość fali światła wzbudzającego, często dłuższa nawet od fali światła fluorescencji zachodzącej w analogicznym przypadku, co nazywamy przesunięciem Stokesa [4].
Trzeba też zaznaczyć, że czas i intensywność fosforescencji zależy w dużej mierze od temperatury. W wyższej temperaturze, na skutek silnych drgań termicznych cząstek dochodzi do bardziej efektywnego rozpraszania energii, co pociąga za sobą zmniejszenie intensywności, a nawet całkowity zanik fluorescencji.
Opisane zjawisko wykazuje wiele substancji. Pierwszymi otrzymanymi przez człowieka były tak zwane kamienie bolońskie, będące jednym z ciekawszych osiągnięć siedemnastowiecznych alchemików. Z chemicznego punktu widzenia były one siarczkami metali - głównie baru Ba, wapnia Ca i cynku Zn – do których sieci krystalicznych wprowadzono śladowe ilości jonów innych metali, takich jak np. miedz Cu, srebro Ag i inne. Zachęcam Czytelników do własnych eksperymentów, zarówno z omawianymi dziś organicznymi układami fosforescencyjnymi, jak i z opisanymi przeze mnie w jednym z dawniejszych numerów „Chemii w Szkole” substancjami analogicznymi do kamieni bolońskich [5].
Literatura:
- [1] Katsumata T., Sasajima K., Nabae T., Komuro S., Morikawa T., Characteristics of Strontium Aluminate Crystals Used for Long-Duration Phosphors, Journal of the American Ceramic Society, 2005, 81 (2), str. 413–416 powrót
- [2] Pluciński T., Doświadczenia chemiczne, Wydawnictwo Adamantan, Warszawa, 1997 powrót
- [3] Ples M., Więcej światła! O fluorescencji rywanolu, Chemia w Szkole, 6 (2015), Agencja AS Józef Szewczyk, str. 16-18 powrót
- [4] Jabłoński A., Efficiency of Anti-Stokes Fluorescence in Dyes, Nature, vol. 131, 1933 powrót
- [5] Ples M., Jak uwięzić światło? O skutkach domieszkowania siarczku cynku, Chemia w Szkole, 1 (2017), Agencja AS Józef Szewczyk, str. 12-18 powrót
Wszystkie fotografie i rysunki zostały wykonane przez autora
Uzupełnienie autora
Jako dodatek do powyższego artykułu chciałbym zaprezentować film:
Marek Ples