Infiltracja - w głąb liścia
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (6/2019):

Rośliny, podobnie jak zwierzęta, muszą prowadzić wymianę gazową z otaczającym je środowiskiem. Z racji różnic fizjologicznych inny jest oczywiście mechanizm całego zjawiska, ale wspólny jest problem regulacji całego procesu. Rośliny, których części nadziemne są pokryte nieprzenikliwą dla gazów warstwą kutykuli, rozwiązują ten problem przy wykorzystaniu wyspecjalizowanych struktur nazywanych szparkami lub aparatami szparkowymi.
U roślin dwuliściennych, niektórych jednoliściennych, nagonasiennych, a także mchów i paprotników cały aparat szparkowy składa się z dwóch komórek szparkowych otoczonych bezpośrednio komórkami epidermy. Najczęściej komórki te mają kształt nerkowaty i tworzą owalny otwór, nazywany też porem aparatu szparkowego. Zgrubienia ścian tych komórek powodują, że zamknięta szparka jest szczelna. U innych grup roślin aparaty szparkowe mogą mieć inną budowę, a w ich skład wchodzą często także pomocnicze komórki towarzyszące, nazywane przyszparkowymi. Możemy więc wyróżnić następujące rodzaje aparatów szparkowych:
- anizocytyczny - występują 3 komórki przyszparkowe, w tym jedną mniejsza od pozostałych,
- diacytyczny - występują 2 komórki przyszparkowe ułożone prostopadle do osi szparki,
- paracytyczny - występują 2 komórki przyszparkowe ułożone równolegle do osi szparki,
- tetracytyczny - występują 4 komórki przyszparkowe,
- anomocytyczny - komórki otaczające aparat szparkowy nie odróżniają się od komórek epidermy [1].
Bywa stosowane rozróżnienie między szparkami zbudowanymi jedynie z dwóch komórek, a aparatami szparkowymi utworzonymi z większej ich liczby.
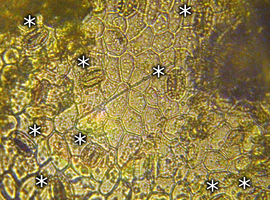
Proste obserwacje opisanych struktur nie wymagają skomplikowanego lub drogiego sprzętu. Wystarczy tu mikroskop szkolny, a nawet przyrząd zbudowany samodzielnie z kamery internetowej, według opisu zamieszczonego w jednym z dawniejszych numerów Biologii w Szkole [2]. Na fot.1 możemy zaobserwować szparki na dolnej powierzchni liści winorośli.
Czy jeśli nie posiadamy jakiegokolwiek mikroskopu możemy zbadać rozmieszczenie aparatów szparkowych na liściach roślin, a także określić wpływ różnorodnych czynników na stopień ich otwarcia? Odpowiedź jest twierdząca, ponieważ prowadzenie tego rodzaju obserwacji umożliwia genialnie prosta metoda infiltracji opracowana przez botanika Hansa Molischa [3].
Doświadczenie
W naszych pracach możemy wykorzystać liście wielu gatunków roślin, np. lipy drobnolistnej Tilia cordata czy szerokolistnej Tilia platyphyllos, orlika pospolitego Aquilegia vulgaris (objętego od 2014 roku częściową ochroną gatunkową - doświadczenia możemy więc wykonywać jedynie na uprawnych odmianach ozdobnych tej rośliny), a także wielu gatunków z rodzaju róża Rosa [4]. Ja w swoich doświadczeniach użyłem liści winorośli właściwej Vitis vinifera, rosnącej w moim ogrodzie (Fot.2).
Winorośl właściwa jest nazywana nazywana często winoroślą lub latoroślą winną. Jest to gatunek rośliny z rodziny winoroślowatych Vitaceae. Naturalny obszar występowania dzikiego podgatunku winorośli obejmował duże obszary w basenie Morza Śródziemnego i Azji południowo-zachodniej [5]. Winorośl uprawna, stanowiąca osobny podgatunek, uległa rozpowszechnieniu na całym świecie. Z jej owoców wytwarza się wina, a poza tym wykorzystuje się je do bezpośredniego spożycia (w postaci świeżej lub suszonej - jako rodzynki) i na przetwory: soki, dżemy, galaretki. Warto też wspomnieć, że z nasion winorośli tłoczy się wartościowy olej.
Pojedyncze liście winorośli rozmieszczone są skrętolegle, posiadają ogonki liściowe o długości 4-8 cm, a ich kształt jest dłoniasty [6]. U ich nasady występują szybko odpadające przylistki. Oba wymiary blaszki liściowej, tj. jej długość i szerokość, są podobne i zawierają się zwykle w granicach 5-15cm.
Do doświadczenia powinniśmy wybrać liście nieuszkodzone, bez przebarwień i śladów żerowania owadów. Sam eksperyment najlepiej jest przeprowadzić na liściach żywych, nie odciętych od reszty organizmu rośliny i o dobrej ekspozycji na światło słoneczne. Oczywiście, na czas samych obserwacji czy wykonania fotografii liście można usunąć i przenieść w odpowiednie miejsce.
Fotografia 3 ukazuje liść wybrany do doświadczenia. Został on podzielony na dwie części, nazwane A i B. Dla ułatwienia granica między obszarami została zaznaczona za pomocą czarnego flamastra. Na obie części będziemy w odpowiedni sposób nanosili czynnik infiltrujący.
Czynnikiem infiltrującym mogą być różne ciecze zwilżające kutykulę, czyli cienką warstwę pokrywającą zewnętrzną ścianę komórek epidermy, obecną na powierzchni wszystkich nadziemnych organów roślin z wyjątkiem pędów zdrewniałych. Kutykula tworzy ciągłą warstwę na powierzchni całej rośliny, poza porami aparatów szparkowych. Odpowiednią cieczą, z racji łatwej dostępności, niskich kosztów i stosunkowo niewielkiej toksyczności będzie nafta (Fot.4). Musimy jedynie pamiętać, że nafta może być drażniąca dla naszej skóry, wdychanie jej par jest szkodliwe, trzeba także brać pod uwagę jej łatwopalność.
Wybrany liść powinien zostać zwilżony niewielką ilością nafty, np. przy pomocy pędzelka. W opisanym przypadku obszar A został zwilżony jedynie po stronie grzbietowej liścia (górnej, zwróconej zwykle ku słońcu), zaś obszar B jedynie po stronie brzusznej (dolnej).
Po czasie rzędu kilku, kilkunastu minut liść został ścięty i umieszczony na ciemnym jednolitym tle, tak by można było dokonać obserwacji (Fot.5).
Możemy w ten sposób przekonać się, że obszary liścia zwilżone naftą po stronie brzusznej (B) wydają się być wyraźnie ciemniejsze niż zwilżone po stronie grzbietowej (A) i to niezależnie od tego, z której strony będziemy widzieć liść.
Obserwacje możemy prowadzić także w świetle przechodzącym, np. umieszczając liść na tle kalki technicznej podświetlonej od tyłu lampą (Fot.6).
W tym przypadku zaobserwujemy odwrotny efekt niż poprzednio: Obszar A wydaje się ciemniejszy niż obszar B.
Z obserwacji można wyciągnąć wniosek, że z jakichś powodów pod działaniem nafty obszar B stał się bardziej przejrzysty, natomiast w przypadku obszaru A nie zanotowaliśmy tej zmiany. Dlaczego?
Wyjaśnienie
Kutykula doskonale spełnia swoje zadanie i nawet nafta, która ją zwilża nie przenika przez jej warstwę. Ciecz może się przedostać do leżących głębiej tkanek jedynie przez pory aparatów szparkowych. Nafta przedostając się przez aparaty szparkowe wypełnia znajdujące się w ich sąsiedztwie przestwory komórkowe i przesącza się dalej, wnikając w przestrzenie i szczeliny między kolejnymi komórkami. Pociąga to za sobą wzrost przejrzystości tkanki. Różnica w wyniku doświadczenia w zależności od tego, która powierzchnia liścia zostanie zwilżona wynika z nierównomiernego rozmieszczenia aparatów szparkowych. W przypadku winorośli – podobnie jak u wielu innych roślin – struktury te są położone głównie na spodniej (czyli inaczej brzusznej) powierzchni liści.
Można wypróbować także odmienne ciecze różniące się łatwością zwilżania kutykuli i wnikania do liści, np. alkohole, benzynę (wyłącznie ekstrakcyjną) i inne. Za każdym razem trzeba stosować odpowiednie środki bezpieczeństwa.
Wiemy, że rośliny posiadają zdolność do regulacji stopnia otwarcia aparatów szparkowych, dzięki czemu mogą np. ograniczać parowanie wody w warunkach wysokiej temperatury środowiska. Wykorzystując opisaną metodę możemy w stosunkowo łatwy sposób pośrednio obserwować stopień otwarcia aparatów szparkowych np. w nocy, rano, w porze największych upałów i popołudniem. Wartymi zbadania czynnikami może być także intensywność oświetlenia liści i temperatura otoczenia. Za każdym razem wskaźnikiem otwarcia lub zamknięcia - oraz stanów pośrednich - może być fakt (lub jego brak) wnikania czynnika infiltrującego do wnętrza liści i szybkość tego procesu. Opisane w tekście obserwacje zostały wykonane w godzinach przedpołudniowych, w niezbyt wysokiej temperaturze.
Opisana metoda jest nieskomplikowana i mało kłopotliwa, dzięki czemu wydaje się być jak najbardziej odpowiednia do zastosowania w warunkach szkolnej lub hobbystycznej pracowni biologicznej. Zachęcam Czytelników do własnych doświadczeń!
Literatura:
- [1] Broda B., Zarys botaniki farmaceutycznej, Państwowy Zakład Wydawnictw Lekarskich, Warszawa, 1975, str. 86-87 powrót
- [2] Ples M., Nieprzyzwoicie tani mikroskop, Biologia w Szkole, 4 (2015), Forum Media Polska Sp. z o.o., str. 55-60 powrót
- [3] Grosse E., Z biologią za pan brat – eksperymenty biologiczne, Państwowe Wydawnictwo „Iskry”, Warszawa, 1969, str. 74-75 powrót
- [4] Rozporządzenie Ministra Środowiska z dnia 9 października 2014 r. w sprawie ochrony gatunkowej roślin (Dz.U. z 2014 r. nr 0, poz. 1409) powrót
- [5] Pipia I., Gamkrelidze M., Gogniashvili M., Tabidze V., Genetic diversity of Georgian varieties of Vitis vinifera subsp. sylvestris, Genetic Resources and Crop Evolution, 61, 2014, str. 1507-1502 powrót
- [6] Godet J.-D., Drzewa i krzewy, Multico Oficyna Wydawnicza, Warszawa, 1997, str. 154. powrót
Autorem fotografii i rysunków jest Marek Ples.
Marek Ples