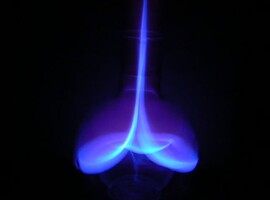
Ognista fala
Według definicji płomień jest to gaz emitujący światło, co jest skutkiem zachodzących w nim reakcji pirolizy i utleniania. Płomień jest obszarem, w którym zachodzi spalanie jednofazowe. Znaczy to, że paliwo i utleniacz istnieją w fazie gazowej. Dochodzi wtedy do emisji ciepła oraz promieniowania elektromagnetycznego, głównie w postaci podczerwieni i światła widzialnego.
Sam płomień jest dosyć skomplikowanym zjawiskiem; w jego obrębie można wyznaczyć wiele stref różniących się właściwościami i zachodzącymi w nich procesami. Wygląd płomienia zależy od wielu czynników. Na poniższym zdjęciu został przedstawiony wygląd płomienia palnika bunsenowskiego przy różnej zawartości tlenu.

Dobierając odpowiednie warunki można uzyskać zaskakujący wygląd i zachowanie się płomienia.

Pewnym urozmaiceniem doświadczenia jest fakt towarzyszącego mu - zaskakującego w tych okolicznościach - efektu akustycznego.
Wykonanie
By przeprowadzić doświadczenie potrzebujemy dużego naczynia szklanego o wąskiej szyjce. Po eksperymentach jakie przeprowadziłem okazało się, że najodpowiedniejsze do tego celu jest widoczna poniżej duża szklana butla. Jej pojemność wynosi 10dm3.
Jako paliwo wykorzystamy 99% alkohol izopropylowy (CH3)2CHOH. Używa się go do czyszczenia elementów optycznych i jego zdobycie nie stanowi problemu.
Ostrzeżenie: Izopropanol (CH3)2CHOH może być szkodliwy. Należy unikać wdychania par tej lotnej cieczy. Przy zanieczyszczeniu innymi substancjami, albo w razie nieprawidłowego prowadzenia doświadczenia może dojść do eksplozji i rozerwania szklanego naczynia. Należy stosować środki ochrony osobistej! Autor nie bierze jakiejkolwiek odpowiedzialności za wszelkie mogące powstać szkody. Robisz to na własne ryzyko!
Przygotowanie doświadczenia jest proste: do naczynia trzeba wprowadzić kilka mililitrów izopropanolu, nakryć i pozostawić do odparowania. Ciecz jest stosunkowo lotna, więc powinno to zająć kilka, najwyżej kilkanaście minut. Doświadczenie warto jest prowadzić w stosunkowo niskiej temperaturze, najwyżej 15°C. Wtedy utlenianie alkoholu zachodzi spokojniej i łatwiej zaobserwować opisywany efekt.
Po odparowaniu alkoholu wystarczy przyłożyć płomień do otwartej szyjki naczynia. Efekt można zobaczyć na moim filmie:
Po dokonaniu zapłonu możemy zaobserwować interesujące zjawisko: powstaje płaski, kolisty płomień podążający stosunkowo powoli w dół. Jednocześnie można usłyszeć dźwięk o dosyć niskiej częstotliwości. Płomień gaśnie dopiero po dotarciu do dna naczynia.
Wyjaśnienie
Wyjaśnienie obserwowanego zjawiska jest stosunkowo proste. Izopropanol jest lotnym, łatwopalnym alkoholem. Jego pary są cięższe od powietrza, zbierają się więc przy dnie wypierając powietrze wraz z zawartym w nim tlenem.
Do utleniania potrzebne są oba składniki: paliwo i tlen. Razem występują jedynie na styku warstwy par alkoholu i powietrza. Jest to powodem płaskiej formy płomienia. W czasie spalania paliwo jest zużywane, co objawia się zmniejszeniem objętości alkoholu w fazie gazowej. Dlatego obserwujemy wędrówkę kolistego płomienia w dół.
Co szczególnie interesujące, w obrębie płomienia można zauważyć powstanie dosyć regularnego układu komórek konwekcyjnych. Jest to swoisty przykład samoorganizacji, którego efekt przypomina zjawiska opisane po raz pierwszy przez Bénarda. Wspomniany uczony badał procesy konwekcyjne w cieczach.
W czasie spalania dochodzi do uwolnienia pewnych ilości gazów: dwutlenku węgla CO2 i pary wodnej H2O. Uchodzą one z dużą prędkością przez wąską szyjkę butelki, co powoduje powstanie drgań będących źródłem dźwięku. Po ustaniu spalania powstaje drugi dźwięk - jest on jednak dużo krótszy i cichszy. Powodem tego jest zmniejszanie się objętości ochładzających się gazów pozostałych w naczyniu. Dźwięk jest wtedy spowodowany powietrzem zasysanym do wnętrza naczynia.
Życzę miłej i pouczającej zabawy:)
Literatura dodatkowa
- Bénard H., Les tourbillons cellulaires dans une nappe liquide, Revue Générale des Sciences, 1900, 11, str. 1261-1271, 1309-1328
- Getling A. V., Rayleigh–Bénard Convection: Structures and Dynamics, World Scientific, 1998
Marek Ples